题目内容
17.元素性质呈现周期性变化的原因是( )| A. | 元素原子的原子半径出现周期性变化 | |
| B. | 元素的化合价出现周期性变化 | |
| C. | 元素原子的电子层数出现周期性变化 | |
| D. | 元素原子的核外电子排布出现周期性变化 |
分析 根据随原子序数的递增,原子的结构呈现周期性的变化而引起元素的性质的周期性变化来解答.
解答 解:A.因元素的原子半径是元素的性质,不能解释元素性质的周期性变化,故A错误;
B.因元素的化合价属于元素的性质,则不能解释元素性质的周期性变化,故B错误;
C.元素周期律是元素原子的核外电子排布出现周期性变化的必然结构,不是电子层数出现周期性变化,故C错误;
D.因原子的核外电子排布中电子层数和最外层电子数都随原子序数的递增而呈现周期性变化,则引起元素的性质的周期性变化,故D正确,
故选:D.
点评 本题考查元素周期律的实质,明确原子的结构与性质的关系、元素的性质有哪些是解答的关键,并注意不能用元素本身的性质来解释元素性质的周期性变化.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
17.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 含有0.5NA个氮原子的氮气质量为14g | |
| B. | NA个氧分子与NA个氢分子的质量比是16:1 | |
| C. | 19.6g硫酸所含的硫原子数为0.1NA | |
| D. | 含有0.3NA个氧原子的O3质量为3.2g |
5.碘硫化学循环原理如图一所示.
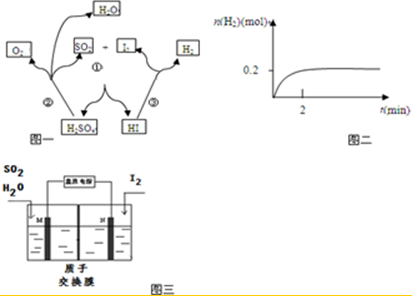
(1)写出反应③的化学方程式2HI?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图二所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
I.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
II. 调节pH并连续搅拌24小时
III.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1 223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为43:7.
(5)由于该循环中H2SO4 与HI发生副反应造成反应器堵塞,因此有科学家用图三所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.

(1)写出反应③的化学方程式2HI?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图二所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
I.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
II. 调节pH并连续搅拌24小时
III.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1 223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1 200-1 350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4 与HI发生副反应造成反应器堵塞,因此有科学家用图三所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
2.下列叙述中正确的是( )
| A. | 铝的摩尔质量为27g | |
| B. | 常温常压下,46g NO2中含有的氧原子数为2NA | |
| C. | 标准状况下,22.4L水中所含有的水分子数NA | |
| D. | 0.1mol•L-1的MgCl2溶液中氯离子物质的量浓度为0.1mol•L-1 |
9.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述不正确的是( )
| A. | 葡萄糖能发生氧化反应 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| D. | 蛋白质中只含C、H、O三种元素. |
6.某金属氧化物化学式为R2O3,相对分子质量为102,电子数为50,已知氧原子核内有8个中子,R原子核内中子数是( )
| A. | 27 | B. | 13 | C. | 21 | D. | 14 |
7.请你利用所学的“化学与生活”相关知识,从化学品的安全使用、环境保护、化学药物等角度评价下面4位同学谈话所涉及的内容,其中合理的是( )
| A. | 为了时尚,我准备把头发染红 | |
| B. | 青霉素等抗生素对病原体有抑制和杀灭作用,这是“治本”而不是“治标” | |
| C. | 趁“家电下乡”的机会,我建议家里买一台“无氟冰箱” | |
| D. | 我国应该禁止在食品中添加防腐剂 |
 己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.
己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.