题目内容
18.某课外活动小组进行电解饱和食盐水的实验(如图).请同答下列问题.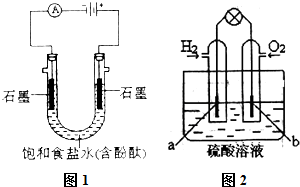
(1)通电一段时间后,可观察到阴极电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为2H2O+2e-=H2↑+2OH-.
(2)该溶液电解反应的化学方程式为2NaCl+2H2$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH.
(3)若将电解质溶液改成CuSO4溶液,则阳极的电极反应式为4OH--4e-═O2+2H2O.
(4)若用H2和O2为反应物,以H2SO4溶液为电解质溶液,可构成新型燃料电池(如下图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电.其中a是负极(填“正”或“负”),b极的电极反应式为O2+4H++4e-═2H2O_.
分析 (1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红;
(2)阳极是还原性强的氯离子放电,阴极是氢离子放电生成氢气;
(3)将电解质溶液改成CuSO4溶液,则阳极氢氧根离子失电子发生氧化反应;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应,电极反应方程式为:O2+4H++4e-═2H2O;
解答 解:(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H2O+2e-=H2↑+2OH-,故答案为:阴极;2H2O+2e-=H2↑+2OH-;
(2)阳极是还原性强的氯离子放电,阴极是氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
(3)将电解质溶液改成CuSO4溶液,则阳极氢氧根离子失电子发生氧化反应,电极反应方程式为:4OH--4e-═O2+2H2O;故答案为:4OH--4e-═O2+2H2O;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应,故答案为:负; O2+4H++4e-═2H2O.
点评 本题考查了原电池电解池原理的分析应用,电极反应,电极判断是解题关键,题目难度中等.

练习册系列答案
相关题目
8.下列有关物质应用的说法中,正确的是( )
| A. | MgO常用作耐高温材料 | |
| B. | 工业上用氯气和澄清石灰水为原料制漂白粉 | |
| C. | 在医学上Na2CO3是一种用于治疗胃酸过多的药剂 | |
| D. | 工业上通过电解氯化钠溶液制取金属钠 |
9.下列物质的水溶液显酸性的是( )
| A. | FeCl3 | B. | NaOH | C. | CH3COONa | D. | Na2SO4 |
13.下列关于铜电极的叙述正确的是( )
| A. | 在电解池中,铜作阳极,溶液中的阴离子在铜极上失电子 | |
| B. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| C. | 用电解法精炼铜时,粗铜作阴极 | |
| D. | 电解稀H2SO4制H2、O2时,铜作阳极 |
3.已知利用某些有机物之间的转代可贮存太阳能,如降冰片二烯(NBD)经太阳光照射转化成四环烷(Q)的反应为 ,下列叙述中错误的是( )
,下列叙述中错误的是( )
 ,下列叙述中错误的是( )
,下列叙述中错误的是( )| A. | Q的能量高于NBD | B. | NBD和Q均属于不饱和烃 | ||
| C. | Q的一氯代物只有3种 | D. | NBD的同分异构体可以是芳香烃 |
7.除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是( )
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | Al2O3(SiO2):NaOH溶液 | D. | NaHCO3溶液(Na2CO3):Ca(OH)2溶液 |