题目内容
9.下列物质的水溶液显酸性的是( )| A. | FeCl3 | B. | NaOH | C. | CH3COONa | D. | Na2SO4 |
分析 A.FeCl3是强酸弱碱盐,在溶液中水解;
B.氢氧化钠是碱;
C.醋酸钠是强碱弱酸盐,在溶液中水解;
D.硫酸钠是强酸强碱盐,在溶液中不水解.
解答 解:A.FeCl3是强酸弱碱盐,在溶液中水解显酸性,故A正确;
B.氢氧化钠是碱,显碱性,故B错误;
C.醋酸钠是强碱弱酸盐,在溶液中水解显碱性,故C错误;
D.硫酸钠是强酸强碱盐,在溶液中不水解,故溶液显中性,故D错误.
故选A.
点评 本题考查了电解质的电离和盐的水解,关键抓住溶液呈酸碱性是何种离子,题目不难.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
19.工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为1.0L的密闭容器中充入0.5mol N2(g)和1.0mol H2(g),某温度下反应达到平衡时容器内压强为原来的$\frac{2}{3}$,则该反应的平衡常数( )
| A. | 4 | B. | 16 | C. | 32 | D. | 64 |
17.某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子.
①取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加过量稀硝酸,白色沉淀不消失.
②在上述①溶液的滤液中加入过量NaOH溶液,出现白色沉淀.
则原溶液中可能大量存在的阴离子是( )
①取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加过量稀硝酸,白色沉淀不消失.
②在上述①溶液的滤液中加入过量NaOH溶液,出现白色沉淀.
则原溶液中可能大量存在的阴离子是( )
| A. | Cl- | B. | NO3- | C. | CO32- | D. | OH- |
14.相同条件下,下列有关物质的比较中,错误的是( )
| A. | 离子半径:Cl->Br- | B. | 单质的氧化性:I2<Br2 | ||
| C. | 酸性:HCl>HF | D. | 热稳定性:H2O>H2S |
19.某反应的微观示意图如下(一种小球代表一种元素的原子),下列说法错误的是( )


| A. | 该反应中共有三种元素 | B. | 图中反应物都是化合物 | ||
| C. | 该反应的本质是原子的重新组合 | D. | 该反应前后分子的种类发生改变 |
 则:
则: ;
;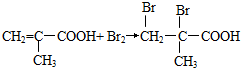 .
.