题目内容
【题目】亚硝酰硫酸[M(NOSO4H)=127g·mol-1]主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
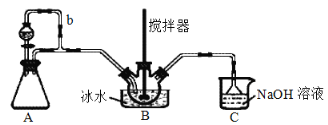
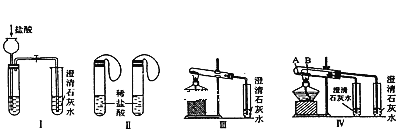
(1)装置A制取SO2,则A中反应的化学方程式为___,导管b的作用是___。
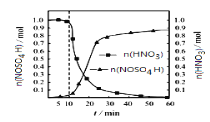
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。反应进行到10min后,反应速度明显加快,其可能的原因是___。
(3)装置C的主要作用是__。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
达到滴定终点时的现象为__,亚硝酰硫酸的纯度为__。
【答案】Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 平衡压强,使分液漏斗中的液体能顺利流下 生成的NOSO4H对该反应有催化作用 吸收尾气中的有毒气体,防止污染环境 C装置中的水蒸气会进入B中使NOSO4H分解 溶液恰好由紫红色变为无色,且半分钟内不恢复 84.7%
【解析】
装置A中利用硫酸和亚硫酸钠反应制取二氧化硫,导管b可以平衡A和分液漏斗上部压强,使分液漏斗中的液体顺利滴下,生成的二氧化硫在装置B中与浓硫酸和浓硝酸的混合液反应制取NOSO4H,浓硝酸会挥发,且易分解产生二氧化氮,同时还有未反应的二氧化硫,装置C可以进行尾气吸收,同时防止倒吸。
(1)实验室一般利用硫酸和亚硫酸钠反应制取二氧化硫,方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;导管b可以平衡压强,使分液漏斗中的液体能顺利流下;
(2)装置B中二氧化硫与浓硫酸和浓硝酸的混合液反应制取NOSO4H,根据题干信息可知浓硫酸主要是用来溶解反应生成NOSO4H,反应进行到10min后,反应速度明显加快,综合考虑影响反应速率的因素温度(反应过程中维持体系温度不高于20℃)、浓度(反应过程中浓度降低)、催化剂可知,加快的原因应为生成的NOSO4H对该反应有催化作用;
(3)根据分析可知,装置C的作用为吸收尾气中的有毒气体,防止污染环境;
(4)C装置中的水蒸气会进入B中使NOSO4H分解,从而导致产量降低;
(5)滴定终点时草酸根将高锰酸根完全反应,所以溶液会显无色,滴定终点现象为:溶液恰好由紫红色变为无色,且半分钟内不恢复;消耗草酸钠溶液的体积为20.00mL,浓度为0.2500mol·L-1,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O可知,剩余成n(MnO4-)=![]() 0.02L×0.2500mol·L-1=0.002mol,所以NOSO4H消耗的n(MnO4-)=0.06L×0.1000mol·L-1-0.002mol=0.004mol,根据方程式2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4可知n(NOSO4H)=0.004mol×
0.02L×0.2500mol·L-1=0.002mol,所以NOSO4H消耗的n(MnO4-)=0.06L×0.1000mol·L-1-0.002mol=0.004mol,根据方程式2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4可知n(NOSO4H)=0.004mol×![]() =0.01mol,所以样品的纯度为
=0.01mol,所以样品的纯度为![]() =84.7%。
=84.7%。