题目内容
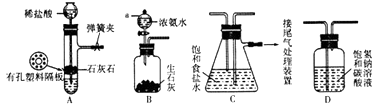
【题目】海洋是生命的摇篮,有关海洋中部分资源的利用如图所示,回答下列问题 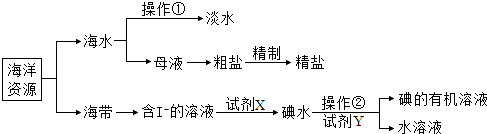
(1)操作①是 , 操作②使用的主要玻璃仪器是;
(2)含I﹣溶液中加入试剂X的目的是将I﹣(填“氧化”或“还原”)成I2;试剂Y选择原则包括:与碘不反应、碘在Y中的溶解度大于在水中的溶解度和;
(3)为除去粗盐中含有硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质,将杂质转化为沉淀过滤除去,再向滤液中加入适量盐酸得到精盐水.该工程示意如下: 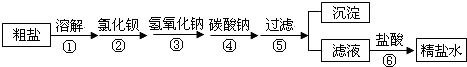
以下叙述正确的是(双选)
A.①操作中需要进行搅拌,目的是提高氯化钠的溶解度
B.③、④两步操作顺序可以颠倒
C.⑤操作得的沉淀中共有三种物质
D.⑥操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(4)海水资源也可以提炼出铝,铝制品与铁制品相比,在空气中不易锈蚀,原因是:
【答案】
(1)蒸馏法(或者电渗析法、离子交换法等);分液漏斗
(2)氧化;不溶于水(或者分层)
(3)BD
(4)铝在空气中易形成一层致密的氧化膜
【解析】解:(1)海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,操作②为萃取,萃取操作使用的主要玻璃仪器为分液漏斗,所以答案是:蒸馏法(或者电渗析法、离子交换法等);分液漏斗;(2)含I﹣溶液中碘元素的化合价为﹣1价,单质中碘元素的化合价为0,则在反应中碘元素的化合价升高,碘元素被氧化,所以含I﹣溶液中加入试剂X的目的是将I﹣氧化,萃取剂选取条件为:萃取剂与溶质不发生反应,萃取剂与原溶剂不互溶且密度不同,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,所以碘在Y中的溶解度大于在水中的溶解度和不溶于水(或者分层),
所以答案是:氧化;不溶于水(或者分层);(3)A.一定温度下,氯化钠的溶解度是固定不变的,不会因搅拌就改变其溶解度,只会加快氯化钠的溶解速度,故A错误;
B.③④可以颠倒,不影响钡离子、镁离子沉淀,但注意氯化钡和碳酸钠的顺序不能颠倒,故B正确;
C.加入过量的氯化钡溶液,可以将硫酸根离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,所以⑤操作中得到的沉淀共有四种,故C错误;
D.⑥操作中,加入适量盐酸的目的是除去过量的氢氧化钠和碳酸钠从而得到氯化钠溶液呈中性,故D正确.
所以答案是:BD;(4)铁生锈是与空气中的氧气和水等物质共同作用的结果,铝与空气中的氧气反应,生成致密的氧化铝膜,起到保护作用,所以性质活泼的铝在空气中不易锈蚀,
所以答案是:铝在空气中易形成一层致密的氧化膜.

 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
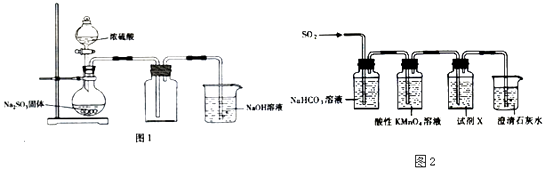
第三学期赢在暑假系列答案【题目】在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)该反应为____________反应(选填吸热、放热),原因是_____________________。
(3)能判断该反应是否达到化学平衡状态的依据是________________(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______________℃。该温度下,若向容器中分别加入2mol H2和2molCO2,10s后达到平衡,则这段时间内υ(H2)=_______________, CO2的转化率为_____________。