题目内容
【题目】某研究性学习小组在实验室模拟工业“侯氏制碱法”原理制取NaHCO3 . 下图是该学习小组进行模拟实验时所用到的主要装置. 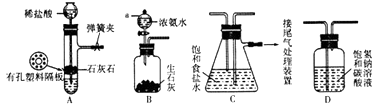
请回答下列问题:
(1)B装置中仪器a的名称是 .
(2)C装置中发生的现象是 , 反应的化学方程式是
(3)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,向漏斗里注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若 . 说明装置不漏气.
(4)D是连接在装置A与装置C之间的气体净化装置,装置D的作用是 .
(5)实验时向饱和NaCl溶液中先通入NH3 , 再通入CO2的原因是 .
(6)设计实验方案,检验NaHCO3产品中是否含有氯化钠
【答案】
(1)分液漏斗
(2)液面上下波动有白色固体析出;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)长漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降
(4)除去二氧化碳中的氯化氢
(5)使溶液呈碱性,二氧化碳更易被吸收
(6)取少量产品溶于水,加入足量的稀硝酸,再滴加硝酸银溶液,若有白色沉淀生成,则证明产品中有氯化钠
【解析】解:“侯氏制碱法”原理制取NaHCO3流程:反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,装置A:制取二氧化碳,装置B:制取氨气,装置C:用二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,装置D:除去二氧化碳中的氯化氢,所以A接D后接C.(1)B装置中仪器a带有玻璃活塞,控制滴加浓氨水的速率,为分液漏斗,所以答案是:分液漏斗;(2)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,由于碳酸氢钠的溶解度较小,所以会出现白色浑浊,现象为液面上下波动有白色固体析出,
所以答案是:液面上下波动有白色固体析出;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;(3)随水的注入管内加压增大,漏斗内液体不能再流入试管,使长颈漏斗与管内液面出现液面差,并且液面差保持不变,说明装置气密性良好,所以答案是:长漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;(4)装置A:制取二氧化碳,用碳酸钙和盐酸反应,盐酸易挥发,制取的二氧化碳中混有氯化氢,装置D内盛放的碳酸氢钠溶液能与二氧化碳中的HCl发生反应生成氯化钠、水和二氧化碳,从而除去HCl,二氧化碳气体与碳酸氢钠溶液不反应所以答案是:除去二氧化碳中的氯化氢;(5)二氧化碳与水反应形成不稳定的碳酸,致使水吸收二氧化碳量较少,氨气在水中的溶解度大于二氧化碳,先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,所以答案是:使溶液呈碱性,二氧化碳更易被吸收;(6)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子,所以答案是:取少量产品溶于水,加入足量的稀硝酸,再滴加硝酸银溶液,若有白色沉淀生成,则证明产品中有氯化钠.