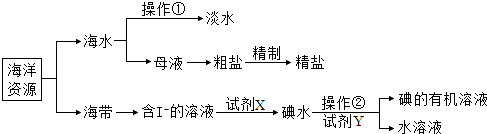
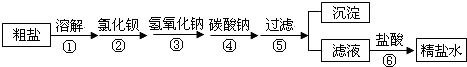
题目内容
【题目】某兴趣小组为深度学习“二氧化硫的性质“,设计了如下系列实验:
(1)用图1装置制取并收集SO2以验证其氧化性 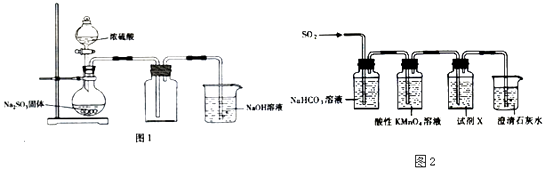 ①实验时为控制SO2产牛的快慢.应采取的措施是;
①实验时为控制SO2产牛的快慢.应采取的措施是;
②烧杯中NaOH溶液的作用是;
③将燃着的Mg条迅速插人集满SO2的集气瓶中,发现Mg条继续燃烧,则反应后生成的含硫物质可能是(填化学式,写出一种即可).
(2)用图2装置验证H2SO3比H2CO3的酸性强 ④酸性KMn04溶液可以吸收S02 , 将其氧化而除去,自身被还原为Mn2+ , 写出该反应的离子方程式;
⑤试剂X是;
⑥当观察到 , 即证明H2SO3比H2CO3酸性强.
【答案】
(1)控制滴浓硫酸的速度;吸收SO2气体,防止污染环境;S、MgS
(2)5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;品红溶液;品红溶液不褪色,澄清石灰水变浑浊
【解析】解:(1)根据装置图可知,实验中用亚硫酸钠与浓硫酸反应制二氧化硫,用向上排空气法收集,用氢氧化钠溶液吸收二氧化硫尾气,①实验时为控制SO2产生的快慢,可以控制滴浓硫酸的速度,所以答案是:控制滴浓硫酸的速度;②二氧化硫有毒,会污染空气,所以要进行尾气吸收,所以烧杯中NaOH溶液的作用是吸收SO2气体,防止污染环境,
所以答案是:吸收SO2气体,防止污染环境;③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,发生氧化还原反应,硫的化合价降低,根据化合价升降推测可知,反应后生成的含硫物质可能是S、MgS、MgS和S、S和MgSO3 ,
所以答案是:S、MgS;(2)验证H2SO3比H2CO3酸性强,可以用亚酸与碳酸盐反应生成二氧化碳即可,所以将二氧化硫通入碳酸钠溶液中,用高锰酸钾溶液除去混合气体中的二氧化硫,用品红溶液检验二氧化硫是否除尽,除去二氧化硫后如果澄清石灰水变浑,则说明有二氧化碳产生,即可证明H2SO3比H2CO3酸性强.④二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平得到,5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;
所以答案是:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;⑤根据上面的分析可知,试剂X是 品红溶液,其作用是 检验SO2是否除尽,
所以答案是:品红溶液;⑥当观察到 品红溶液不褪色,说明SO2已经除尽,澄清石灰水变浑浊,即证明H2SO3比H2CO3酸性强,
所以答案是:品红溶液不褪色,澄清石灰水变浑浊.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】现应用酸碱中和滴定法测定某市售白醋的含酸量.
Ⅰ.实验步骤
(1)用___________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_________作指示剂.
(3)读取盛装0.1000 molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为_______mL.
![]()
(4)滴定.滴定过程中,眼睛应注视__________________________; 当滴至____________________________________时停止滴定,并记录NaOH溶液的终读数.重复滴定4次.
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol·L-1 NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | 15.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可折算得c(市售白醋)=________molL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)
a.碱式滴定管在装液前未用标准NaOH溶液润洗.
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失.
c.锥形瓶中加入待测白醋溶液后,再加少量水.
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.