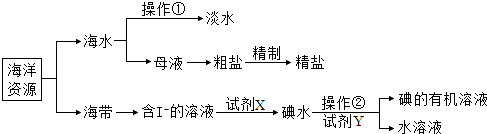
��Ŀ����
����Ŀ�������Ϊ2L���ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��________________��
��2���÷�ӦΪ____________��Ӧ��ѡ�����ȡ����ȣ���ԭ����_____________________��
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������________________����ѡ�۷֣���
a��������ѹǿ���� b����������� c��CO������
c��������H2����������H2O�� d��c��CO2����c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ _______________�档���¶��£����������зֱ����2mol H2��2molCO2��10s��ﵽƽ�⣬�����ʱ������(H2)=_______________, CO2��ת����Ϊ_____________��
���𰸡� ![]() ���� �¶����ߣ�ƽ�ⳣ������ƽ�������ƶ���������Ӧ���� b��c 830 0.05mol/(L s) 50 %
���� �¶����ߣ�ƽ�ⳣ������ƽ�������ƶ���������Ӧ���� b��c 830 0.05mol/(L s) 50 %
����������1����ѧ��Ӧƽ�ⳣ����������Ũ�ȵ�ϵ���η�����ٱ��Ϸ�Ӧ��Ũ�ȵ�ϵ���η���ˣ�������![]() ��
��
��2���÷�Ӧ�����¶ȵ�����ƽ�ⳣ��Kֵ����������������Ӧ�����ȷ�Ӧ��
��3��������ѹǿ���������������ʵ������䣬�÷�Ӧ���������������ʵ�������ķ�Ӧ�����Բ���˵����Ӧ��ƽ�⣬ѡ��a����������� c��CO�����䣬˵����Ӧ��ֹͣ���ˣ�����Ӧ�ﵽƽ��״̬��ѡ��b��ȷ��������H2����������H2O����˵����Ӧ�����淴Ӧ�����������Ӧ��ƽ����ѡ��c��ȷ��c��CO2����c��CO��������û��˵����ʱ��ı�����ô�п��ܳ���˲�������Ȼ��仯������ѡ��d������
��4��ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O��������Ӧ��K=1�����ݱ������ݵõ����÷�Ӧ���¶�Ϊ830�������¶��£�����������2L���зֱ����2mol H2��CO2������
CO2��g����H2��g��![]() CO��g����H2O��g��
CO��g����H2O��g��
��ʼ�� 1 1 0 0
��Ӧ�� X X X X
ƽ���� 1-X 1-X X X �����ϵ�λΪmol/L��
������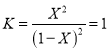 �����X=0.5mol/L��
�����X=0.5mol/L��
����![]()
![]()