题目内容
铅蓄电池的反应原理为:2PbSO4+2H2O Pb+PbO2+2H2SO4,下列叙述中,正确的是
Pb+PbO2+2H2SO4,下列叙述中,正确的是
| A.PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B.放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C.放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D.充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
C
解析试题分析:A、PbSO4的氧化性比PbO2的弱、还原性比Pb的弱,错误;B、放电时,PbO2为氧化剂、做正极,Pb为还原剂、做负极,错误;C、根据化合价变化得H2SO4与电子转移关系:H2SO4 ~ e?,则放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出,正确;D、充电时,PbSO4中+2价Pb得电子转化为Pb, Pb为阴极产物,错误。
考点:本题考查原电池和电解池原理。

练习册系列答案
相关题目
下图为某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置,下列有关说法错误的是:
| A.溶液中OH-由阴极区流向阳极区 |
| B.阳极区产生的气体与阴极区产生的气体在相同状况下体积之比为1:2 |
| C.阳极的电极反应式为:2H2O-4e-=O2↑+4H+ |
| D.Na2CrO4转化为Na2Cr2O7的离子方程式为:2CrO42-+2H+= Cr2O72-+H2O |
如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法中正确的是( )
A.X为负极,电极反应为:Si-4e- Si4+ Si4+ |
B.X为正极,电极反应为:4H2O+4e- 4OH-+2H2↑ 4OH-+2H2↑ |
C.X为负极,电极反应为:Si+6OH--4e- Si+3H2O Si+3H2O |
D.Y为负极,电极反应为:Fe-2e- Fe2+ Fe2+ |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-=SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )。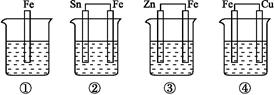
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是( )。
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等金属离子对土壤和水源的污染 |
| C.不使电池中渗泄的电解液腐蚀其他的物品 |
| D.回收其中的石墨电极 |
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )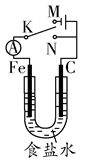
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 ( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
下列说法不正确的是 ( )
| A.粗铜电解精炼时,应将粗铜与直流电源的正极相连 |
| B.金属的吸氧腐蚀的过程中,正极的电极反应式为O2+2H2O+4e-=4OH- |
| C.燃料电池中加入燃料的电极一定是电池的负极 |
| D.在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |