题目内容
【题目】工业上可以利用废气中的CO2为原料制取甲醇。请回答下列问题:
(1) 已知常温常压下,下列两个可逆反应的能量变化如下图所示:
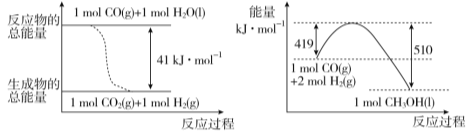
请写出左图反应的平衡常数表达式K= 。
请写出由二氧化碳和氢气制备甲醇的热化学方程式 。
(2) 如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先减小后增大
(3) 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填字母)。
A.H2的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时,n(H2)/n(CH3OH)增大
(4) 保持温度和体积不变,通入1molCO2和3molH2,下列能说明该反应已达平衡状态的是________(填字母)。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CO2的消耗速率之比为3∶1
D.容器内气体的平均相对分子质量保持不变
(5) 若反应容器的容积为2.0 L,反应时间4.0 min,容器内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
(6) 有人设计甲醇-空气燃料电池电源,用石墨作电极电解200 mL含有下列离子的溶液:
离子 | Cu2+ | H+ | Cl- | SO |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为____________(忽略溶液体积的变化及电极产物可能存在的溶解现象)。也有人用此电源利用电解法制备Na2FeO4,阳极材料为铁,其电解质溶液用NaOH溶液,阳极反应式为 。
【答案】
(1)K=![]() ;CO2(g)+3H2(g)
;CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-50kJ·mol-1;
CH3OH(l)+H2O(l) ΔH=-50kJ·mol-1;
(2)AD;(3)BC;(4)BD;(5)0.01mol·(L·min)-1;
(6)3.2g;Fe-6e-+8OH-=FeO42-+4H2O
【解析】
试题分析:(1)图1中的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,平衡常数表达式为K=![]() ;②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,由②-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
;②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,由②-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)如果反应方程式CO2+3H2CH3OH+H2O的平衡常数K值变大,则需要降低温度,A.降低温度,平衡一定向正反应方向移动,故A正确;B.降低温度后,正逆反应速率都减小,正反应速率在达到平衡前始终在减小,故B错误;C.平衡常数变大,反应物浓度减小,生成物浓度增大,则化学平衡一定向正反应方向移动,故C错误;D.化学平衡常数变大,需要降低温度,则正逆反应速率都减小,由于平衡向着正向移动,则逆反应速率先减小后增大,故D正确;故答案为:AD;
(3) 根据CO2+3H2CH3OH+H2O,在其他条件不变的情况下,将容器体积压缩到原来的1/2,压强增大,平衡正向移动,所有物质的浓度均增大,A.H2的浓度增大,错误;B.增大压强,反应速率加快,正反应速率加快,逆反应速率也加快,正确;C.平衡正向移动,甲醇的物质的量增加,正确;D.平衡正向移动,重新平衡时,n(H2)/n(CH3OH)减小,错误;故选BC;
(4) A.平衡时,各物质的浓度不变,但n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1不表示物质的量不变,不能表示已达平衡状态,错误;B.该反应属于气体的物质的量发生变化的反应,容器内压强保持不变,说明物质的量不变,能够说明已达平衡状态,正确;C.H2的消耗速率与CO2的消耗速率都表示正反应速率,不能表示已达平衡状态,错误;D容器内气体的质量不变,物质的量发生变化,因此容器内气体的平均相对分子质量保持不变,能够说明已达平衡状态,正确;故选BD;
(5) 若反应的容器容积为2.0L,反应时间4.0min,容器内气体的密度减小了2.0g/L,则气体减小的质量为:2.0g/L×2.0L=4.0g,
CO2(g)+3H2(g)=CH3OH(l)+H2O(l) 气体减少质量△m
1mol 50
n 4.0g
反应消耗的二氧化碳的物质的量为:n=![]() =0.08mol,
=0.08mol,
在4min内C02的平均反应速率为: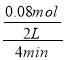 =0.01mol.L-1.min-1,故答案为:0.01 mol·(L·min)-1;
=0.01mol.L-1.min-1,故答案为:0.01 mol·(L·min)-1;
(6) 电解过程中,开始阴极是Cu2+放电生成Cu,没有气体生成,阳极是Cl-放电生成Cl2,电解一段时间后,标况下当两极收集到相同体积的气体,说明阳极上氢离子放电生成H2,由于氢离子、氯离子浓度相等,则二者物质的量相等,等量的氢离子、氯离子放电生成氢气、氯气体积相等,根据电子转移守恒,氯离子放电完毕时,氢离子有剩余,二者最终两极生成氢气体积相等,故阳极上氯离子放电完毕,且氢氧根离子放电,溶液中含有n(Cu2+)=0.5mol/L×0.2L=0.1mol,n(Cl-)=2mol/L×0.2L=0.4mol,根据氯原子守恒可知生成氯气为0.2mol,设生成氧气为x mol,则生成氢气为(x+0.2)mol,根据电子转移守恒:0.1mol×2+(x+0.2)mol×2=0.2mol×2+x mol×4,解得x=0.1,故生成氧气的质量为0.1mol×32g/mol=3.2g,用此电源利用电解法制备Na

【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
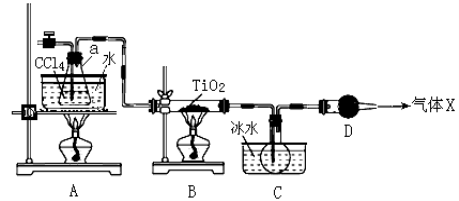
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
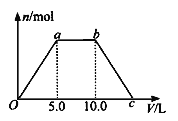
⑤ 若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。