ћвƒњƒЏ»Ё
°Њћвƒњ°њNH3 «÷Ў“™µƒїѓє§‘≠Ѕѕ°£ƒ≥ µ—й “ґ‘∞±∆шљш––ѕ¬Ѕ–—–Њњ°£
£®1£©ѕаЌђќ¬ґ»ѕ¬£ђ‘Џ»эЄцћеїэЊщќ™2.0LµƒЇг»Ё√№±’»Ё∆ч÷–ЈҐ…ъЈі”¶£ЇN2(g)£Ђ3H2(g) ![]() 2NH3(g)£ђЈі”¶єэ≥ћ÷–≤вґ®µƒ≤њЈ÷ эЊЁЉыѕ¬±н£Ї
2NH3(g)£ђЈі”¶єэ≥ћ÷–≤вґ®µƒ≤њЈ÷ эЊЁЉыѕ¬±н£Ї
»Ё∆ч±аЇ≈ | ∆р ЉЄчќп÷ µƒќп÷ µƒЅњ/mol | ∆љЇвќп÷ µƒЅњ(mol) | ∆љЇв—є«њ(Pa) | ||
N2(g) | H2(g) | NH3(g) | NH3(g) | ||
Ґс | 4 | 12 | 0 | 4 | P1 |
Ґт | 2 | 6 | 0 | C2 | P2 |
Ґу | 1.5 | 4.0 | 3 | ? | ? |
Ґў»ф»Ё∆чҐс÷–Јі”¶50√лµљіп∆љЇв£ђ‘тЄ√ ±ґќv(H2)= mol/(L°§s)
ҐЏ»Ё∆чҐс°ҐҐт÷–Јі”¶Њщµљіп∆љЇв ±c2 2;p1 2p2(ћо°∞>°±°Ґ°∞<°±їт°∞=°±)
Ґџ»Ё∆чҐу÷–£ђіпµљ∆љЇв«∞v(’э) v(ƒж) (ћо°∞>°±°Ґ°∞<°±їт°∞=°±)
£®2£©Ґў“—÷™£ЇN2(g)+3H2(g)![]() 2NH3(g) °чH=-92.4kJ/mol
2NH3(g) °чH=-92.4kJ/mol
N2(g)+O2(g)=2NO(g) °чH=180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) °чH=-483.6 kJ/mol
‘т4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)£ї°чH= KJ/mol
4NO(g)+6H2O(g)£ї°чH= KJ/mol
ҐЏљЂ4molNH3ЇЌ5molO2Ј÷±р÷√”Џ5ЄцћеїэѕаЌђ°Ґќ¬ґ»≤їЌђµƒ»Ё∆ч÷–‘Џ≤ђѕµіяїѓЉЅ„ч”√ѕ¬љш––Јі”¶£ђѕаЌђ ±ЉдЇу≤вЅњ5Єц»Ё∆ч÷–N≤ъ¬ »зЌЉЋщ Њ°£ѕ¬Ѕ–ЋµЈ®’э»Јµƒ « (ћо„÷ƒЄ)°£
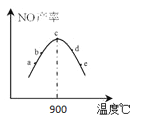
A£Ѓaµгv(’э)іу”Џv(ƒж)
B£ЃcµгЈі”¶Ћў¬ „оњм
C£Ѓќ¬ґ»Єя”Џ900°ж ±£ђNO≤ъ¬ ѕ¬љµµƒ‘≠“т «“тќ™ќ¬ґ»…эЄяµЉ÷¬∆љЇвƒжѕт“∆ґѓ
£®3£©∞± «“ї÷÷«±‘Џµƒ«ељаƒ№‘і£ђњ…”√„чЉо–‘»ЉЅѕµз≥Ўµƒ»ЉЅѕ°£µз≥Ўµƒ„№Јі”¶ќ™£Ї4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)°£‘тЄ√»ЉЅѕµз≥ЎµƒЄЇЉЂЈі”¶ љ « °£
°Њір∞Є°њ
£®1£©Ґў0.06£ї ҐЏ<£ї<£їҐџ< £ї
£®2£©Ґў-905£їҐЏAC£ї
£®3£©2NH3£≠6e°™+6OH°™=N2+6H2O£ї
°Њљвќц°њ
‘ћвЈ÷ќц£Ї£®1£©ҐўЄщЊЁN2(g)£Ђ3H2(g) ![]() 2NH3(g)£ђ…ъ≥…4mol∞±∆ш£ђ–и“™Јі”¶6mol«в∆ш£ђ»ф»Ё∆чҐс÷–Јі”¶50√лµљіп∆љЇв£ђ‘тЄ√ ±ґќv(H2)=
2NH3(g)£ђ…ъ≥…4mol∞±∆ш£ђ–и“™Јі”¶6mol«в∆ш£ђ»ф»Ё∆чҐс÷–Јі”¶50√лµљіп∆љЇв£ђ‘тЄ√ ±ґќv(H2)=![]() =0.06mol/(L°§s)£ђє ір∞Єќ™£Ї0.06£ї
=0.06mol/(L°§s)£ђє ір∞Єќ™£Ї0.06£ї
ҐЏ»Ё∆чҐс”лҐтѕа±»£ђҐс÷–Јі”¶ќпµƒќп÷ µƒЅњќ™Ґт÷–µƒ2±ґ£ђѕаµ±”Џґ‘Ґтљш––Љ”—є£ђ‘ціу—є«њ£ђ∆љЇв’эѕт“∆ґѓ£ђ∆љЇв ±c2£Љ![]() c1£ђЉіc2£Љ2;p1£Љ2p2£ђє ір∞Єќ™£Ї<£ї<£ї
c1£ђЉіc2£Љ2;p1£Љ2p2£ђє ір∞Єќ™£Ї<£ї<£ї
Ґџ‘Џ»Ё∆чҐс∆љЇв ±£ђµ™∆шќ™2mol£ђ«в∆шќ™6mol£ђ∞±∆шќ™4mol£ђ∆љЇв≥£ эK= =
=![]() £ђ»Ё∆чҐу÷–Qc=
£ђ»Ё∆чҐу÷–Qc= =
=![]() £Њ
£Њ![]() £ђіпµљ∆љЇв«∞Јі”¶ѕтƒжЈі”¶Јљѕтљш––v(’э)£Љv(ƒж)£ђє ір∞Єќ™£Ї< £ї
£ђіпµљ∆љЇв«∞Јі”¶ѕтƒжЈі”¶Јљѕтљш––v(’э)£Љv(ƒж)£ђє ір∞Єќ™£Ї< £ї
£®2£©ҐўN2(g)+O2(g)®T2NO(g)°чH=+180.5kJ/mol Ґў£ђN2(g)+3H2(g)®T2NH3(g)°чH=-92.4kJ/mol ҐЏ£ђ2H2(g)+O2(g) ®T2H2O(g) °чH=-483.6kJ/mol Ґџ£ђ”…Є«Ћєґ®¬…Ґў°Ѕ2-ҐЏ°Ѕ2+Ґџ°Ѕ3µ√£Ї4NH3(g)+5O2(g)®T4NO(g)+6H2O(g) °чH=-905.0kJ/mol£їє ір∞Єќ™£Ї4NH3(g)+5O2(g)=4NO(g)+6H2O(g)°чH=-905.0kJ/mol£ђє ір∞Єќ™£Ї-905£ї
ҐЏЄщЊЁЌЉѕс£ђcµгќ™900°ж ±µƒ∆љЇв„іћђ£ђЋж„≈ќ¬ґ»µƒ…эЄя£ђNOµƒ≤ъ¬ љµµЌ£ђ∆љЇвƒжѕт“∆ґѓ£ђЋµ√чЄяЈі”¶µƒ’эЈі”¶ «Ј≈»»Јі”¶°£A£Ѓaµг «љ®ЅҐ∆љЇв÷Ѓ«∞µƒєэ≥ћ£ђv(’э)іу”Џv(ƒж)£ђє A’э»Ј£їB£Ѓќ¬ґ»‘љЄя£ђЈі”¶Ћў¬ ‘љњм£ђЈі”¶Ћў¬ „оњмµƒ «eµг£ђє Bінќу£їC£Ѓќ¬ґ»Єя”Џ900°ж ±£ђNO≤ъ¬ ѕ¬љµµƒ‘≠“т «“тќ™ќ¬ґ»…эЄяµЉ÷¬∆љЇвƒжѕт“∆ґѓ£ђє C’э»Ј£їє —°AC£ї
£®3£©‘≠µз≥ЎЄЇЉЂЈҐ…ъ—хїѓЈі”¶£ђ∞±∆ш‘ЏЄЇЉЂ І»•µз„”£ђЉо–‘ћхЉюѕ¬…ъ≥…µ™∆ш”лЋЃ£ђЄЇЉЂµзЉЂЈі”¶ љќ™£Ї2NH3+6OH--6e-=N2+6H2O£ђє ір∞Єќ™£Ї2NH3+6OH--6e-=N2+6H2O°£