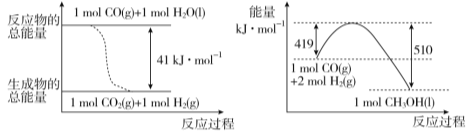
题目内容
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
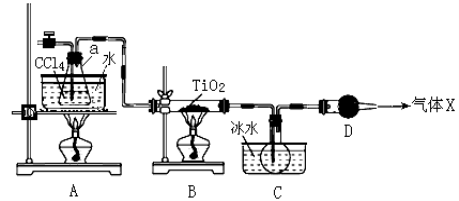
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
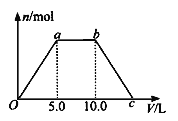
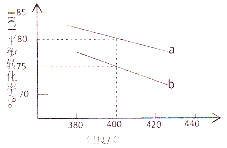
⑤ 若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
【答案】(1)①MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;②加入的碳单质与氧气反应,减小了产物O2的浓度,使反应TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
Mn2++Cl2↑+2H2O;②加入的碳单质与氧气反应,减小了产物O2的浓度,使反应TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
(2)①先排尽系统(装置)中的空气;②受热均匀,能为反应提供稳定的CCl4蒸汽流;
③TiO2+CCl4![]() TiCl4+CO2;④蒸馏;⑤NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3-
TiCl4+CO2;④蒸馏;⑤NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3-
【解析】
试题分析:(1)①实验室用二氧化锰与浓盐酸在加热条件下反应生成二氯化锰、氯气和水,离子方程式为MnO2 +4H++2Cl-![]() Mn2++Cl2 ↑+2H2O;② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使反应 TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
Mn2++Cl2 ↑+2H2O;② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使反应 TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
(2)① 根据题给信息知TiCl4遇潮湿空气产生白雾,故实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气。② 本实验中仪器a采用题给的加热方式为水浴加热,突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流。③ B中CCl4与TiO2发生反应生成TiCl4和二氧化碳,化学方程式是TiO2+CCl4![]() TiCl4+CO2。④ C装置中为四氯化碳和四氯化钛的混合物,二者沸点不同,故欲分离C装置中的TiCl4,应采用的实验操作为蒸馏。⑤将反应过程中生成的气体二氧化碳缓缓通入Ba( OH)2和NaOH的混合稀溶液中,发生的反应依次为:Oa段:CO2+Ba(OH)2
TiCl4+CO2。④ C装置中为四氯化碳和四氯化钛的混合物,二者沸点不同,故欲分离C装置中的TiCl4,应采用的实验操作为蒸馏。⑤将反应过程中生成的气体二氧化碳缓缓通入Ba( OH)2和NaOH的混合稀溶液中,发生的反应依次为:Oa段:CO2+Ba(OH)2![]() BaCO3↓+H2O;ab段:CO2+2NaOH
BaCO3↓+H2O;ab段:CO2+2NaOH![]() Na2CO3+H2O、CO2+Na2CO3+H2O
Na2CO3+H2O、CO2+Na2CO3+H2O![]() 2NaHCO3;bc段:CO2+BaCO3+H2O
2NaHCO3;bc段:CO2+BaCO3+H2O![]() 2Ba(HCO3)2。b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3 + H2O+CO2 = Ba2+ +2HCO3-。
2Ba(HCO3)2。b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3 + H2O+CO2 = Ba2+ +2HCO3-。