��Ŀ����
����Ŀ���������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�
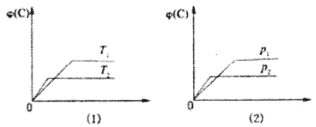
��1����ͼΪC����������ı仯��ϵͼ�����ٱ仯���û���Ӧ�����仯ѧ����ʽ��Ϊ___��
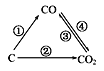
��2��һ�������£����ܱ������з�����ӦCO2(g)��C(s)![]() 2CO(g)�ﵽƽ�⣬��ʹƽ��������Ӧ�����ƶ�����__(����ĸ)��
2CO(g)�ﵽƽ�⣬��ʹƽ��������Ӧ�����ƶ�����__(����ĸ)��
A.���������������䣬����ѹǿ
B.����������������䣬ͨ������Ar
C.����̼������
D.���������������䣬�����¶�
��3����������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ��H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ��H=+640.4kJ/mol
д��CO���廹ԭFeO����õ�Fe�����CO2������Ȼ�ѧ��Ӧ����ʽ��__��
���𰸡�H2O(g)��C![]() CO��H2��SiO2��2C
CO��H2��SiO2��2C![]() Si��2CO���� D FeO(s)+CO(g)=Fe(s)+CO2(g) ��H=-218.0kJ/mol
Si��2CO���� D FeO(s)+CO(g)=Fe(s)+CO2(g) ��H=-218.0kJ/mol
��������
(1)C�ܽ�CuO�е�ͭ, SiO2��Si�û�����;
(2)���ݻ�ѧƽ��״̬�仯���ؽ��з�����
(3)���ݸ�˹���ɣ�ֱ����⡣
(1) �����û���Ӧ������̼�Ͷ������跴Ӧ����һ����̼�裬��Ӧ�Ļ�ѧ����ʽΪSiO2��2C![]() Si��2CO����������������ﷴӦ����Ӧ�Ļ�ѧ����ʽΪH2O(g)��C
Si��2CO����������������ﷴӦ����Ӧ�Ļ�ѧ����ʽΪH2O(g)��C![]() CO��H2���ʴ�Ϊ��H2O(g)��C
CO��H2���ʴ�Ϊ��H2O(g)��C![]() CO��H2��SiO2��2C
CO��H2��SiO2��2C![]() Si��2CO���ȡ�
Si��2CO���ȡ�
(2) A.���������������䣬����ѹǿ��ƽ�������������С�ķ�����У��ʼ�С�ܱ��������ݻ��������¶Ȳ��䣬ƽ��������У�������̼Ũ������A�����
B. Ar�������������� ���뵪���������ܱ��������ݻ����¶Ȳ��䣬��ϵ��ѹ���������ѹ���䣬ƽ�ⲻ�ƶ���c(CO2)���䣬B�����
C. C�ǹ��壬����C����ѧƽ�ⲻ�ƶ���һ����̼Ũ�Ȳ��䣬C�����
D. CO2��g��+C��s��=2CO��g����H��0����Ӧ�����ȷ�Ӧ������ƽ�������ƶ���һ����̼Ũ������D����ȷ��
D��ȷ���ʴ�Ϊ��D��
(3) ��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g������Fe2O3��s��+![]() CO��g��=
CO��g��=![]() Fe3O4��s��+
Fe3O4��s��+![]() CO2��g������Fe3O4��s��+CO��g��=3FeO��s��+CO2��g�������ݸ�˹����
CO2��g������Fe3O4��s��+CO��g��=3FeO��s��+CO2��g�������ݸ�˹����![]() �ó�FeO(s)+CO(g)=Fe(s)+CO2(g) ��H =
�ó�FeO(s)+CO(g)=Fe(s)+CO2(g) ��H =![]() =��218.00kJ��mol��1���ʴ�Ϊ��FeO(s)+CO(g)=Fe(s)+CO2(g) ��H=-218.0kJ/mol��
=��218.00kJ��mol��1���ʴ�Ϊ��FeO(s)+CO(g)=Fe(s)+CO2(g) ��H=-218.0kJ/mol��

 �߽�������ϵ�д�
�߽�������ϵ�д�