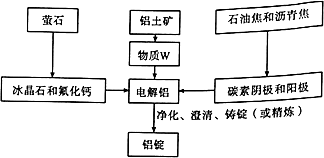
题目内容
7.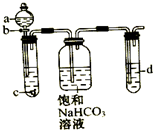 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.根据强酸制弱酸的原理,所选物质要既能证明同族元素性质递变规律,又能证明同周期元素性质递变规律.
所给试剂(供选择)
酸:稀HCl、稀HNO3、稀H2SO4
碱:NaOH、Mg(OH)2、Al(OH)3
盐:CaCO3、Na2SiO3溶液、Ca(ClO)2溶液
(1)填物质名称:a稀硝酸,c碳酸钙,d硅酸钠溶液
(2)观察到的现象有:c产生气泡,碳酸钙溶解,d产生白色沉淀
(3)非金属性由强到弱的顺序是:N>C>Si(用元素符号表示)
分析 (1)元素的非金属性越强,其最高价氧化物的水化物酸性越强、其单质的氧化性越强,根据信息需根据强酸制弱酸的原理探究元素非金属性递变规律:元素非金属性与对应最高价含氧酸之间的关系如图装置来一次性完成,C、N属于同一周期,C、Si属于同一主族,C、N、Si三种非金属元素的非金属性强弱比较,第一支试管中反应是碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳,饱和碳酸氢钠的作用是除去二氧化碳中硝酸蒸气,第三支试管中二氧化碳和硅酸钠反应,证明碳非金属性大于硅;
(2)第一支试管中反应是碳酸钙和稀硝酸反应生成二氧化碳,第三支试管中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳的非金属性大于硅,饱和碳酸氢钠的作用是除去二氧化碳中硝酸蒸气,据此分析观察到的现象;
(3)根据最高价氧化物的水化物酸性越强,其元素的非金属性越强判断.
解答 解:(1)同周期自左而右,核电荷数增大,原子半径减小,原子核对电子吸引增强,失去电子能力减弱,获得电子的能力增强,故同周期从左到右,金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,C、N、Si三种非金属,C、N属于同一周期,C、Si属于同一主族,推知C、N、Si三种元素非金属性的强弱为N>C>Si,根据信息需根据强酸制弱酸的原理探究元素非金属性递变规律:第一支试管装置用来制取二氧化碳,故a为稀硝酸,c为碳酸钙,碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳,硝酸易挥发,故饱和碳酸氢钠的作用是除去二氧化碳中硝酸,第三支试管中为硅酸钠溶液,证明碳非金属性大于硅,
故答案为:稀硝酸;碳酸钙;硅酸钠溶液;
(2)第一支试管中反应是碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,c为碳酸钙,可观察到c产生气泡,碳酸钙溶解,第三支试管中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳的非金属性大于硅,d装置中观察到溶液变浑浊,饱和碳酸氢钠的作用是除去二氧化碳中硝酸,
故答案为:产生气泡,碳酸钙溶解;产生白色沉淀;
(3)最高价氧化物的水化物酸性越强,其元素的非金属性越强,酸性:硝酸>碳酸>硅酸,则非金属性:N>C>Si;
故答案为:N>C>Si.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,注意实验设计的原理和方法,题目难度中等.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案| A. | c(H+) | B. | H+个数 | C. | CH3COOH分子数 | D. | c(H+)/c(CH3COOH) |
| A. | 铁跟稀盐酸反应2Fe+6H+═2Fe3++3H2↑ | |
| B. | 盐酸中加入碳酸钙CO32-+2H+═H2O+CO2↑ | |
| C. | CO2通入足量澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入盐酸CO32-+2H+═H2O+CO2↑ |
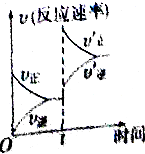 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )| A. | 增大压强 | B. | 降低温度 | C. | 升高温度 | D. | 分离出氨气 |
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选择的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水.(提示:K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀).
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②,振荡 | ③ | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色.
(2)装置B的作用是防倒吸.
(3)经小组讨论并验证该无色气体为O2,其验证方法是用带火星的木条深入集气瓶中,木条复燃证明无色气为氧气.
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有Ag、NO2、O2.