题目内容
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
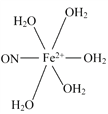
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

【答案】[物质结构与性质]
(1)sp3 平面(正)三角形
(2)[Ar]3d6或1s22s22p63s23p63d6
(3)NO2
(4)1∶2
(5)
【解析】分析:(1)用价层电子对互斥理论分析SO42-中S的杂化方式和NO3-的空间构型。
(2)Fe原子核外有26个电子,根据构造原理写出基态Fe的核外电子排布式,进一步写出Fe2+的核外电子排布式。
(3)用替代法写出O3的等电子体。
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键。
N,三键中含1个σ键和2个π键。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子。
详解:(1)SO42-中中心原子S的价层电子对数为![]() (6+2-4
(6+2-4![]() 2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为
2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为![]() (5+1-3
(5+1-3![]() 2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
(2)Fe原子核外有26个电子,根据构造原理,基态Fe的核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6。
(3)用替代法,与O3互为等电子体的一种阴离子为NO2-。
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子,答案为: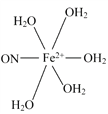 。
。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案