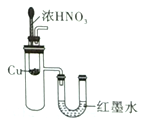
题目内容
【题目】用图所示装置电解硫酸铜和氯化钠的混合溶液,当线路中有1.20mol电子通过时,甲电极增重并有4.48L(已折算成标准状况下的体积,后同)气体生成,乙电极同时生成气体7.84L,则原溶液中硫酸铜与氯化钠的物质的量之比为
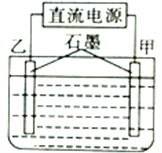
A. 2:1 B. 4:1 C. 2:3 D. 4:3
【答案】A
【解析】分析:本题考查电解原理,根据离子放电顺序,分析电极产物,根据电子守恒解答。
详解:该电解池可能发生的阴极反应为:①Cu2++2e-=Cu、②2H++2e-=H2↑;发生的阳极反应为:③2Cl--2e-=Cl2↑,④2H2O-4e-=4H++O2↑,甲电极增重,并有4.48L气体生成,则氢气体积为4.48L(标准状况),乙电极同时生成气体7.84L(氯气和氧气),反应共转移电子1.20mol,阴极反应中,反应②共得电子0.4mol电子,则反应①共得电子1.2mol-0.4mol=0.8mol,可计算得原溶液中含Cu2+,其物质的量为0.4mol;设阳极产生氯气物质的量为x,产生氧气物质的量为y,则x+y=![]() =0.35mol,共转移电子1.2mol,则2x+4y=1.2,联立两个方程,解得,x=0.1mol,y=0.25mol,所以溶液中含Cl-为0.2mol, 则原溶液中硫酸铜与氯化钠的物质的量之比为0.4:0.2=2:1,故选A项。综上所述,本题正确答案为A。
=0.35mol,共转移电子1.2mol,则2x+4y=1.2,联立两个方程,解得,x=0.1mol,y=0.25mol,所以溶液中含Cl-为0.2mol, 则原溶液中硫酸铜与氯化钠的物质的量之比为0.4:0.2=2:1,故选A项。综上所述,本题正确答案为A。

 阅读快车系列答案
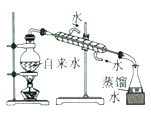
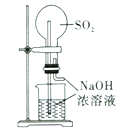
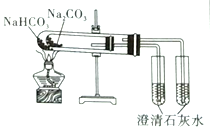
阅读快车系列答案【题目】下列实验装置不能达到实验目的的是
A | B | C | D |
|
|
|
|
实验室制取蒸馏水 | 用SO2和NaOH溶液做喷泉实验 | 证明Na2CO3的热稳定性比NaHCO3好 | 证明铜与浓硝酸的反应是放热反应 |
A. A B. B C. C D. D
【题目】碳捕集封存作为减少温室气体排放的一种手段,受到许多国家的重视,将捕获的二氧化碳转化为可用产品将促进这技术的推广使用。
I.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如图装置(部分条件及物质末标出)。

(1)在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________,可以循环利用的物质是___________ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3溶液的热化学方程式为____________ 。
(3)下列溶液中,同样能用于“捕捉”二氧化碳的是________(填序号)。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
II.在海洋碳循环中,通过如图所示的途径固碳。

(1)写出钙化作用的离子方程式:______________。
(2)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理:________________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_____________。