题目内容
18.在10mL含SO42-、Na+、CO32-的混合溶液中加入过量的BaCl2溶液,生成4.3g沉淀,再将沉淀要用过量和稀HNO3处理,在标准状况下,生成224mL气体,求原混合溶液中Na2SO4与Na2CO3的物质的量浓度各是多少?分析 含SO42-、Na+、CO32-的混合溶液中加入过量的BaCl2溶液,生成的4.3g沉淀为碳酸钡和硫酸钡;将沉淀要用过量和稀HNO3处理,在标准状况下生成224mL气体为二氧化碳,根据C原子守恒及n=$\frac{V}{{V}_{m}}$可计算出碳酸钠的物质的量,从而可知碳酸钡沉淀的质量,然后根据沉淀的总重量得出硫酸钡沉淀的质量,再根据n=$\frac{m}{M}$计算出硫酸钠的物质的量,最后根据c=$\frac{n}{V}$计算出硫酸钠、碳酸钠的物质的量浓度.
解答 解:生成的4.4g沉淀为碳酸钡和硫酸钡的混合物,硫酸钡不溶于稀硝酸,碳酸钡能够溶解于稀硝酸,所以生成的气体为二氧化碳,
标准状况下224mL二氧化碳气体的物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,
根据碳原子守恒碳酸钡沉淀的物质的量为0.01mol,质量为:197g/mol×0.01mol=1.97g,
则硫酸钡的质量为:4.3g-1.97g=2.33g,根据S元素守恒可知硫酸钠的物质的量为:n(Na2SO4)=n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,
所以原混合液中碳酸钠的浓度为:c(Na2CO3)=$\frac{0.01mol}{0.01mol}$=1mol/L,硫酸钠的物质的量浓度为:c(Na2SO4)=$\frac{0.01mol}{0.01L}$1mol/L,
答:原混合溶液中Na2SO4与Na2CO3的物质的量浓度都是1mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握物质的量与物质的量浓度、摩尔质量、气体摩尔体积等物理量之间的关系.

练习册系列答案
相关题目
8.下列反应属于取代反应的是( )
| A. | 甲烷燃烧 | B. | 乙烯与溴水反应 | ||
| C. | 甲烷与氯气在光照下反应 | D. | 甲烷制炭黑 |
9.将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是( )
| A. | 氧气、干冰、硫酸、烧碱 | B. | 碘酒、冰、盐酸、烧碱 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱 | D. | 铜、硫酸钠、醋酸、石灰水 |
13.下列化学反应对应的离子方程式书写正确的是( )
| A. | 碳酸氢钠溶液中加足量NaOH溶液:HCO3-+OH-═CO2 ↑+H2O | |
| B. | 氯化铝溶液中加入过量的氢氧化钠:Al3++OH-═Al(OH)3 ↓ | |
| C. | 过氧化钠与水反应:2Na2O2 +2H2O═4Na++4OH-+O2 ↑ | |
| D. | 氧化铝与盐酸反应:Al2O3+6H+═2Al3++3H2O |
7.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2(g)+O2(g)?2SO3(g),这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率和提高SO2的转化率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度不变 | |
| C. | 达到平衡时,v(SO2)正=v(O2)逆 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
8.食品香精“菠萝酯”的生产路线(反应条件略去)如下.下列叙述正确的是( )
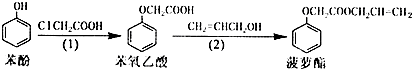
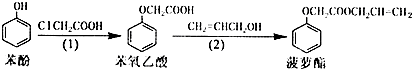
| A. | 苯氧乙酸与菠萝酯互为同系物 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |




 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.