题目内容
10. CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
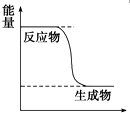
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.Ⅰ.(1)已知CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)能量变化如图,下列说法正确的是CD
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1mol H-O键断裂的同时2mol C=O键断裂,则反应达最大限度
(2)某温度下,将5mol CH3OH和2mol O2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,4min内平均反应速度v(H2)=0.8mol•L-1•min-1,则CH3OH的转化率为64%.
Ⅱ.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.
(3)若电解质为25%的KOH溶液,电池放电时,电解质溶液的碱性逐渐减弱,电池放电时正极的电极反应式为O2+4e-+2H2O═4OH-;
(4)若电解质溶液改为酸溶液,请写出甲醇燃料电池的负极电极反应式CH3OH-6e-+H2O═CO2↑+6H+;
(5)最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入CH3OH,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为O2+4e-=2O2-.电池工作时,固体电解质里的O2-向CH3OH极推动.
(6)与铅蓄电池相比,当消耗相同质量的负极活性物质时,甲醇燃料电池的理论放电量是铅蓄电池的19.4倍(保留一位小数).
分析 (1)A、反应物的能量高于生成物的能量,反应是放热的,反之是吸热的;
B、化学反应速率之比等于系数之比;
C、化学变化伴随物质变化,同时也一定有能量变化;
D、当化学反应得到平衡状态时,反应达到了最大限度.
(2)根据化学反应速率v=$\frac{△c}{△t}$计算反应速率,根据三行式结合转化率等于变化量和初始量的比值计算转化率;
(3)根据电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O知,正极上氧气得电子发生还原反应,根据电池反应式判断溶液的pH值变化;
(4)甲醇燃料电池的负极上是甲醇失电子的氧化反应,据电解质环境书写电极反应式;
(5)正极为氧气得电子发生还原反应,阴离子移向负极;
(6)根据负极上的反应,消耗负极质量减少一样多时,转移得电子的物质的量即可.
解答 解:(1)A、根据图示反应物的能量高于生成物的能量,反应是放热的,故A错误;
B、化学反应速率之比等于系数之比,H2的生成速率与CH3OH的消耗速率之比为2:1,故B错误;
C、化学变化伴随物质变化,同时也一定有能量变化,故C正确;
D、当化学反应得到平衡状态时,反应达到了最大限度,1mol H-O键断裂的同时2mol C=O键断裂,说明正逆反应速率相等,达到了平衡,故D正确;
故选CD;
(2)经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,氧气的变化浓度1.0mol/L-0.2mol/L=0.8mol/L.
CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)
初始浓度:2.5 1 0 0
变化浓度:1.6 0.8 1.6 3.2
末态浓度:0.9 0.2 1.6 3.2
4min内平均反应速度v(H2)=$\frac{3.2mol/L}{4min}$=0.8mol/(L•min),CH3OH的转化率$\frac{1.6}{2.5}$×100%=64%,
故答案为:0.8mol•L-1•min-1;64%;
(3)电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O,反应消耗氢氧根离子,所以反应后溶液的pH减小,碱性减弱,正极上氧气得电子发生还原反应,则反应式为:O2+4e-+2H2O═4OH-;故答案为:减弱;O2+4e-+2H2O═4OH-;
(4)甲醇燃料电池的负极上是甲醇失电子的氧化反应,酸性电解质环境下电极反应式为:CH3OH-6e-+H2O═CO2↑+6H+,故答案为:CH3OH-6e-+H2O═CO2↑+6H+;
(5)正极为氧气得电子发生还原反应,反应式为:O2+4e-=2O2-;O2-向移向负极CH3OH移动,故答案为:O2+4e-=2O2-;CH3OH;
(6)根据负极上的电极反应式:CH3OH-6e-+H2O═CO2↑+6H+,消耗1g甲醇,转移电子的物质的量是$\frac{3}{16}$mol,铅蓄电池的负极上发生的反应为:Pb-2e-+SO42-=PbSO4,
消耗1gPb,转移电子的物质的量是$\frac{2}{207}$mol,所以当消耗相同质量的负极活性物质时,甲醇燃料电池的理论放电量是铅蓄电池的比值是$\frac{3}{16}$=19.4,故答案为:19.4.
点评 本题考查了化学反应速率、平衡的有关计算、原电池原理等知识,明确正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写.

| A. | 矿泉水 | B. | 冰水混合物 | C. | 海水 | D. | 食盐水 |
| A. | 正反应的活化能比逆反应的活化能大146 kJ•mol-1 | |
| B. | 正反应的活化能一定小于146 kJ•mol-1 | |
| C. | 逆反应的活化能一定大于146 kJ•mol-1 | |
| D. | 逆反应的活化能一定大于正反应的活化能 |
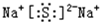 ,化合物BA2的结构式是:S=C=S;
,化合物BA2的结构式是:S=C=S; .
.
 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.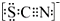 .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究.