题目内容
6.在含有1mol/LAgNO3、1mol/LFe(NO3)2和1mol/LFe(NO3)3,发生如下反应:Fe2++Ag+?Fe3++Ag(s)的平衡常数K=3.求:(1)反应向哪个方向进行;
(2)求平衡时Fe2+、Ag+、Fe3+的浓度各为多少?
(3)Ag+的转化率.
分析 (1)根据K=$\frac{c(F{e}^{3+})}{c(F{e}^{2+})×c(A{g}^{+})}$可知,浓度商Qc=$\frac{1}{1×1}$=1<K=3,故平衡向正反应方向进行;
(2)设平衡时Ag+的浓度变化量为x,利用三段式表示出平衡时各离子的浓度,再根据平衡常数列方程计算解答;
(3)Ag+的转化率=(Ag+的浓度变化量÷Ag+的起始浓度)×100%.
解答 解:(1)根据K=$\frac{c(F{e}^{3+})}{c(F{e}^{2+})×c(A{g}^{+})}$可知,浓度商Qc=$\frac{1}{1×1}$=1<K=3,故平衡向正反应方向进行,
答:反应向正反应进行;
(2)设平衡时Ag+的浓度变化量为xmol/L,则:
Fe2++Ag+?Fe3++Ag(s)
开始(mol/L):1 1 1
转化(mol/L):x x x
平衡(mol/L):1-x 1-x 1+x
所以$\frac{1+x}{(1-x)(1-x)}$=3,解得x=$\frac{1}{3}$,或x=2(舍去)
平衡时c(Fe2+)=(1-$\frac{1}{3}$)mol/L=$\frac{2}{3}$mol/L
c(Ag+)=(1-$\frac{1}{3}$)mol/L=$\frac{2}{3}$mol/L
c(Fe3+)=(1+$\frac{1}{3}$)mol/L=$\frac{4}{3}$mol/L
答:平衡时c(Fe2+)=$\frac{2}{3}$mol/L,c(Ag+)=$\frac{2}{3}$mol/L,c(Fe3+)=$\frac{4}{3}$mol/L;
(3)Ag+的转化率=($\frac{1}{3}$mol/L÷1mol/L)×100%=33.3%,
答:Ag+的转化率为33.3%.
点评 本题考查化学平衡有关计算,涉及平衡常数的应用,难度不大,侧重对基础知识的巩固.

 阅读快车系列答案
阅读快车系列答案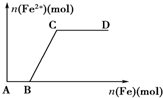 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )| A. | AB段铁元素以①形式存在 | B. | CD段铁元素以③形式存在 | ||
| C. | BC段铁元素以④形式存在 | D. | 以上说法均不正确 |
①NaOH ②NaCN ③NH4Cl ④Na2CO3 ⑤H2O ⑥HCN ⑦HCl.
| A. | ①②③ | B. | ①⑤⑥ | C. | ①③⑤ | D. | ③⑤⑦ |
| A. | 可逆反应“CO(g)+H2O(g)═CO2(g)+H2(g)”中的△H小于0,说明此反应为吸热反应 | |
| B. | 已知S(s)+O2(g)═SO3(g)的反应热为△H═-385.5kJ•mol-1,说明硫的燃烧热为385.5 kJ•mol-1 | |
| C. | 一个化学反应的反应热等于反应物的总能量减去生成物的总能量 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
| A. | 矿泉水 | B. | 冰水混合物 | C. | 海水 | D. | 食盐水 |
| A. | 石蜡油 | B. | 甘油 | C. | 酚醛树脂 | D. | 花生油 |
 ,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为
,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为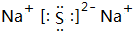 ,化合物中的化学键属于离子键.
,化合物中的化学键属于离子键.