题目内容
在容积固定的容器中发生反应:CO(g)+2H2(g) CH3OH(g) △H<0,各物质的浓度如下表
CH3OH(g) △H<0,各物质的浓度如下表

下列说法不正确的是( )
 CH3OH(g) △H<0,各物质的浓度如下表
CH3OH(g) △H<0,各物质的浓度如下表
下列说法不正确的是( )
| A.2min-4min内用氢气表示的速率为0.3mol/(L?min) |
| B.达平衡时,CO的转化率为62.5% |
| C.反应在第2min时改变了条件,可能是加入了催化刺 |
| D.反应在第2min时改变了条件,可能增加了H2的浓度 |
D
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
初始c: 0.8 1.6 0
△c1: 0.2 0.4 0.2
2min时c: 0.6 1.2 0.2
△c2: 0.3 0.6 0.3
4min时c: 0.3 0.6 0.5
A:由公式可知 0.3mol/(L?min)
0.3mol/(L?min)
B:达平衡时α(CO)=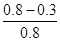 =62.5%
=62.5%
C:反应开始至2min时与2min至4min相比,反应速率加快,可能是加入了催化剂;
D:比较2min与4min两状态下的反应混合物的物质的量浓度可知,如果在2min时增加氢气的浓度,4min时氢气的浓度不可能为0.6mol/L,故排除。
故答案为 D
 CH3OH(g)
CH3OH(g) 初始c: 0.8 1.6 0
△c1: 0.2 0.4 0.2
2min时c: 0.6 1.2 0.2
△c2: 0.3 0.6 0.3
4min时c: 0.3 0.6 0.5
A:由公式可知
 0.3mol/(L?min)
0.3mol/(L?min)B:达平衡时α(CO)=
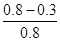 =62.5%
=62.5%C:反应开始至2min时与2min至4min相比,反应速率加快,可能是加入了催化剂;
D:比较2min与4min两状态下的反应混合物的物质的量浓度可知,如果在2min时增加氢气的浓度,4min时氢气的浓度不可能为0.6mol/L,故排除。
故答案为 D

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是  A的转化率一定大于50%
A的转化率一定大于50% 2NH3 (g)从两条途径分别建立平衡:
2NH3 (g)从两条途径分别建立平衡: H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )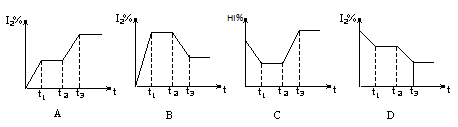
 再前推活塞固定在图乙位置,NO2的转化率将 (填“增大”、“减小”、或“不变”)。
再前推活塞固定在图乙位置,NO2的转化率将 (填“增大”、“减小”、或“不变”)。

 NH3 (g) + HI(g) 2HI(g)
NH3 (g) + HI(g) 2HI(g)