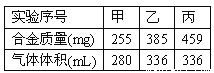
题目内容
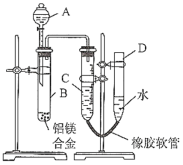
【题目】过氧化钠与二氧化碳能生成氧气,在潜水艇中做制氧剂。某学生为了验证这一实验,利用足量的大理石、盐酸和1.95g Na2O2,制取O2。设计出如下图实验装置
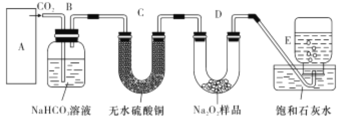
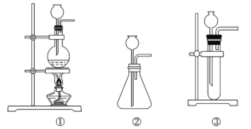
(1)A中制取CO2的图,应选用________(填①或②或③)
写出本题中制取氧气的化学方程式__________________B装置的作用是___________________
(2)若E中的出现少量白色沉淀,说明原因:__________________________________
(3)若D中1.95g Na2O2接近反应完毕时,预测会有何种现象:_______________________
【答案】② 2Na2O2+2CO2=2Na2CO3+ O2 除去CO2中混有的HCl气体 CO2并未全部与Na2O2反应,少许溢出使石灰水变浑浊,E中石灰水浑浊明显增加 集气瓶内液面不再下降
【解析】
(1)A中制取CO2的图,制取二氧化碳是用大理石和盐酸反应,不需要加热,该反应是放热反应,应该用比较大的容器反应;用过氧化钠和二氧化碳的反应,用饱和碳酸氢钠溶液吸收二氧化碳中的氯化氢气体。
(2)二氧化碳未完全反应则可能会使澄清石灰水变浑浊。
(3)当过氧化钠接近反应完,则集气瓶内液面不再下降。
(1)A中制取CO2的图,制取二氧化碳是用大理石和盐酸反应,不需要加热,该反应是放热反应,应该用比较大的容器反应,应选用②,制取氧气主要是二氧化碳和过氧化钠反应,其化学方程式2Na2O2+2CO2=2Na2CO3+ O2,B装置的作用是主要是除掉二氧化碳中的氯化氢,故答案为:②;2Na2O2+2CO2=2Na2CO3+ O2;除掉二氧化碳中的氯化氢。
(2)若E中的出现少量白色沉淀,说明原因CO2并未全部与Na2O2反应,少许溢出使石灰水变浑浊,故答案为:CO2并未全部与Na2O2反应,少许溢出使石灰水变浑浊。
(3)若D中1.95g Na2O2接近反应完毕时,不再生成氧气,出来的二氧化碳和澄清石灰水反应,因此出现集气瓶内液面不再下降,溶液变浑浊,故答案为:集气瓶内液面不再下降。