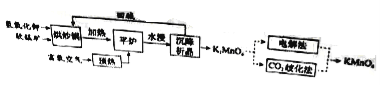
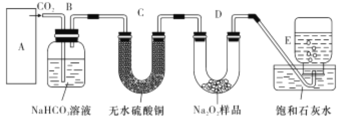
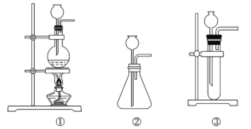
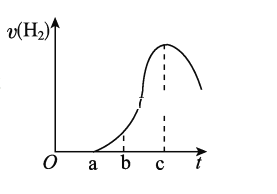
题目内容
【题目】下列化学方程式书写错误的是( )
A.NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B.NH4Cl水解的化学方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C.Al(OH)3的两性电离方程式:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D.NaHSO3的电离方程式:NaHSO3=Na++HSO3-
【答案】A
【解析】
A. NaHCO3水解的离子方程式为HCO3-+H2O ![]() =H2CO3+OH-,HCO3-+ H2O
=H2CO3+OH-,HCO3-+ H2O![]() CO32-+H3O+是其电离方程式,故A错误;
CO32-+H3O+是其电离方程式,故A错误;
B. NH4Cl中铵根离子水解,该物质水解的化学方程式为NH4Cl+H2O![]() NH3·H2O+HCl,故B正确;
NH3·H2O+HCl,故B正确;
C. Al(OH)3可以电离出氢离子和偏铝酸根,也可以电离出铝离子和氢氧根,电离方程式为H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH,故C正确;
Al3++3OH,故C正确;
D. 亚硫酸氢根为弱酸的酸式酸根,所以电离方程式为NaHSO3=Na++HSO3-,故D正确;
故答案选A。

【题目】(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+] |
B.[Na+]=[Cl-]>[H+]>[OH-] |
C.[Na+]=[Cl-]>[OH-]>[H+] |
D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1______C2(填“<”、“=”或“>”)