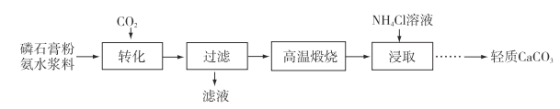
��Ŀ����
����Ŀ��Ϊ��֤������Cl2>Fe3��>SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г������ͼ��м���װ�����ԣ��������Ѽ���)��
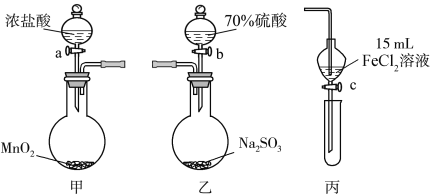
ʵ�鲽�裺
1���ڼ�װ���У�����a�����ȣ���װ���г�������ɫ����ʱ�����װ�����ӡ�
2������װ����FeCl2��Һ���ʱ��ֹͣ���ȡ�
3������c��ʹԼ2 mL����Һ�����Թ��У�������Һ�е����ӡ�
4������װ���У�����b���������ž������в���������ͨ��������װ�ñ�ƺ����Һ�У�һ��ʱ���ֹͣ��
5�����±����Թܣ�����c��ʹԼ2 mL����Һ�����Թ��У�������Һ�е����ӡ�
�ش��������⣺
(1)���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
(2)��70%��������ȡSO2����Ӧ���ʱ���98%������죬ԭ����______________��
(3)ʵ���У�֤��������Fe3����SO2�����ӷ���ʽΪ_________________________��
(4)�Т�����ͬѧ�ֱ����������ʵ�飬ʵ�������£�
����3��Һ�к��е����� | ����5��Һ�к��е����� | |
�� | ����Fe3������Fe2�� | ��SO |
�� | ��Fe3����Fe2�� | ��SO |
�� | ��Fe3����Fe2�� | ��Fe2�� |
����ʵ����һ���ܹ�֤��������Cl2>Fe3��>SO2����________(�����)��
���𰸡�(1)MnO2��4HCl(Ũ) ![]() MnCl2��2H2O��Cl2��
MnCl2��2H2O��Cl2��
(2)70%��������c(H��)��98%�������еĴ�
(3)2Fe3����SO2��2H2O===2Fe2����SO![]() ��4H�� (4)��
��4H�� (4)��
��������(1)�ڼ��ȵ������¶�����������Ũ�����������������Լ��з�����Ӧ�Ļ�ѧ����ʽΪMnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2����(2)70%��������c(H��)��98%��������c(H��)��������Ũ�ȴ�Ӧ���ʿ졣(3)�����Ӿ��������ԣ��ܰ�SO2�����������ᣬ��Ӧ�����ӷ���ʽΪ2Fe3����SO2��2H2O===2Fe2����SO
MnCl2��2H2O��Cl2����(2)70%��������c(H��)��98%��������c(H��)��������Ũ�ȴ�Ӧ���ʿ졣(3)�����Ӿ��������ԣ��ܰ�SO2�����������ᣬ��Ӧ�����ӷ���ʽΪ2Fe3����SO2��2H2O===2Fe2����SO![]() ��4H����(4)����3��Һ�������������ɣ�˵�����������������������������ӡ�������������������ǿ����������������Կ�֪��������Cl2>Fe3��������ʵ���м���Fe3������Fe2����˵���������㣬����SO2��Ӧ��ֻ�������ӡ����ڲ���5��Һ�к���SO
��4H����(4)����3��Һ�������������ɣ�˵�����������������������������ӡ�������������������ǿ����������������Կ�֪��������Cl2>Fe3��������ʵ���м���Fe3������Fe2����˵���������㣬����SO2��Ӧ��ֻ�������ӡ����ڲ���5��Һ�к���SO![]() ����˵�������Ӱ�SO2�������������ᣬ���������Fe3��>SO2������ʵ������Fe3����Fe2���������ų������Ƿ��������ʹ����5��Һ�к���SO
����˵�������Ӱ�SO2�������������ᣬ���������Fe3��>SO2������ʵ������Fe3����Fe2���������ų������Ƿ��������ʹ����5��Һ�к���SO![]() ��Ҳ����˵���DZ������������ģ�������֤��������Fe3��>SO2������ʵ������Fe3����Fe2������Ȼ����˵�������Ƿ�������������ڲ���5��Һ�к����������ӣ���˵���ڷ�Ӧ�������ӱ�SO2��ԭ�����Կ���֤��������Fe3��>SO2����ѡ��
��Ҳ����˵���DZ������������ģ�������֤��������Fe3��>SO2������ʵ������Fe3����Fe2������Ȼ����˵�������Ƿ�������������ڲ���5��Һ�к����������ӣ���˵���ڷ�Ӧ�������ӱ�SO2��ԭ�����Կ���֤��������Fe3��>SO2����ѡ��