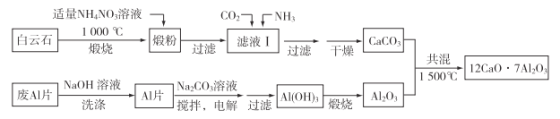
题目内容
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
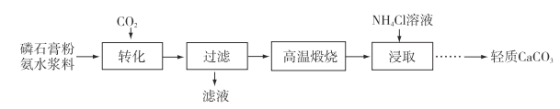
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
【答案】(1)CaSO4+2NH3·H2O+CO2===CaCO3+2NH![]() +SO
+SO![]() +H2O
+H2O
或CaSO4+CO![]() ===CaCO3+SO
===CaCO3+SO![]() AC
AC
(2)SO![]() HCO
HCO![]() 取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2 溶液,若不产生白色沉淀,则表明已洗涤完全
取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2 溶液,若不产生白色沉淀,则表明已洗涤完全
(3)浸取液温度上升,溶液中c(H+)增大,促进固体中Ca2+浸出
【解析】(1)向磷石膏粉、氨水浆料中通入CO2,CO2与NH3·H2O 发生反应:CO2+2NH3·H2O===2NH![]() +CO
+CO![]() +H2O,CO
+H2O,CO![]() 浓度增大,促进了CaSO4沉淀的转化:CaSO4+CO
浓度增大,促进了CaSO4沉淀的转化:CaSO4+CO![]() ===CaCO3+SO
===CaCO3+SO![]() ,总反应的离子方程式为CaSO4+2NH3·H2O+CO2===CaCO3+2NH
,总反应的离子方程式为CaSO4+2NH3·H2O+CO2===CaCO3+2NH![]() +SO
+SO![]() +H2O。
+H2O。
A.搅拌浆料,可增大反应物的接触面积,加快化学反应速率;B.加热浆料,由于NH3的挥发,导致NH3·H2O浓度降低,不利于CO![]() 的生成,降低了CaSO4的转化速率;C.增大氨水浓度,有利于提高CO
的生成,降低了CaSO4的转化速率;C.增大氨水浓度,有利于提高CO![]() 的浓度,从而提高CaSO4的转化速率;D. 减小CO2通入速率,不利于CO
的浓度,从而提高CaSO4的转化速率;D. 减小CO2通入速率,不利于CO![]() 的生成,从而降低CaSO4的转化速率。
的生成,从而降低CaSO4的转化速率。
(2)由图象可知,pH=6.5时,溶液中的c(Ca2+)已经很小,此时通入的CO2与溶液中浓度较低的氨水反应生成NH4HCO3,故溶液中物质的量浓度最大的两种阴离子为SO![]() 和HCO
和HCO![]() 。过滤得到的CaCO3沉淀上会附着SO
。过滤得到的CaCO3沉淀上会附着SO![]() 、NH
、NH![]() 、HCO
、HCO![]() 等杂质离子。检验洗涤是否完全时,可取少量最后一次从过滤器中流出的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,检验是否存在SO
等杂质离子。检验洗涤是否完全时,可取少量最后一次从过滤器中流出的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,检验是否存在SO![]() 即可。若不产生白色沉淀,表明沉淀已洗涤完全。
即可。若不产生白色沉淀,表明沉淀已洗涤完全。
(3)NH4Cl溶液中存在水解平衡:NH![]() +H2O
+H2O![]() NH3·H2O+H+,温度升高,上述水解平衡右移,c(H+)增大,导致部分CaCO3溶解。
NH3·H2O+H+,温度升高,上述水解平衡右移,c(H+)增大,导致部分CaCO3溶解。