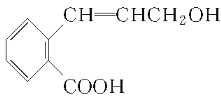
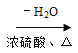
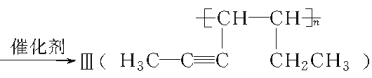
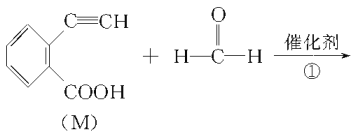题目内容
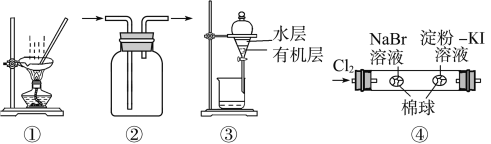
【题目】某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 中的一种或几种,依次进行下列实验,且每步所加的试剂均过量,观察到的现象如下表所示。
中的一种或几种,依次进行下列实验,且每步所加的试剂均过量,观察到的现象如下表所示。
步骤 | 操 作 | 现 象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列实验结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥
【答案】A
【解析】实验①说明原溶液中有能水解的SO![]() ;实验②说明原溶液中一定含有Br-;实验③说明步骤③所得溶液中有SO
;实验②说明原溶液中一定含有Br-;实验③说明步骤③所得溶液中有SO![]() ,则原溶液中至少含有SO
,则原溶液中至少含有SO![]() 、SO
、SO![]() 中的一种;实验④说明溶液中有Cl-,由于步骤②中加入氯水引入了Cl-,则不能确定原溶液中是否含有Cl-;结合①,可知原溶液中一定含有SO
中的一种;实验④说明溶液中有Cl-,由于步骤②中加入氯水引入了Cl-,则不能确定原溶液中是否含有Cl-;结合①,可知原溶液中一定含有SO![]() ;则SO
;则SO![]() 无法确定;由于Ba2+不能与SO
无法确定;由于Ba2+不能与SO![]() 、SO
、SO![]() 共存,则原溶液中一定不含Ba2+;根据电荷守恒,则原溶液中一定含有 Na+。因此肯定含有的离子是①④⑤,肯定没有的离子是②,不能确定的离子是③⑥。
共存,则原溶液中一定不含Ba2+;根据电荷守恒,则原溶液中一定含有 Na+。因此肯定含有的离子是①④⑤,肯定没有的离子是②,不能确定的离子是③⑥。

【题目】I.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下:
时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)放置时,雨水样品酸性_______________(填“增强”、“减弱”或“不变”)。
酸性变化的原因_________________________________(用化学方程式表示)。
II.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(2) 写出一氧化碳与一氧化氮反应的化学方程式:__________________________。
(3) 在“催化转化器”转化后的气体中有CO2、SO2,下列不能鉴别这两种气体的是(____)
A.KMnO4溶液 B.石灰水 C.BaCl2溶液 D.品红溶液
(4) 有效减少城市污染的方法可以有____________
A. 开发氢能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具