题目内容
【题目】已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等。
(1)我国古代炼丹中经常使用到红丹(用X表示),在一定条件下,与过量硝酸能发生非氧化还原反应:X+4HNO3===PbO2+2Pb(NO3)2+2H2O(已配平)。
①PbO2中铅元素的化合价是________,PbO2不是碱性氧化物,判断的依据是_________________________________________________。
②X的化学式是________。
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为____________________________________________。
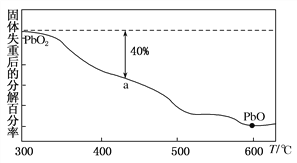
(3)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体。若a点固体组成表示为PbOx,则x=________。
【答案】 +4 PbO2不能与硝酸反应生成盐与水 Pb3O4 PbO+ClO-===PbO2+Cl- 1.6
【解析】试题分析(1) ①根据化合价代数和等于0计算元素化合价;碱性氧化物与酸反应只能生成盐和水;②根据元素守恒判断X的化学式;(2) PbO被次氯酸钠氧化为PbO2;(3)根据元素守恒计算x值。
解析:①根据化合价代数和等于0,PbO2中Pb元素的化合价为+4;碱性氧化物与酸反应只能生成盐和水,PbO2不能与硝酸反应生成盐与水,所以PbO2不是碱性氧化物;②X+4HNO3===PbO2+2Pb(NO3)2+2H2O,根据元素守恒,X的化学式为Pb3O4;(2) PbO被次氯酸钠氧化为PbO2,离子方程式为PbO+ClO-===PbO2+Cl-;(3)根据元素守恒,设原PbO2的物质的量为1mol,a点样品分解40%,则生成PbO 0.4mol,剩余PbO2 0.6mol,所以Pb原子的物质的量为1mol、O原子的物质的量为1.6mol,则PbOx的组成为PbO1.6,x=1.6。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液