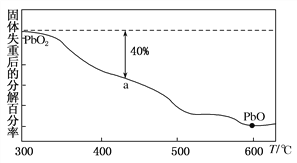
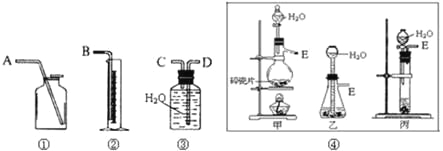
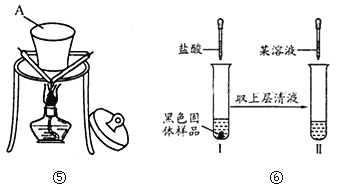
题目内容
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO--)(填“>”、“=”或“<”,下同)。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+) = c(CH3COO--),则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(3)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO--)。
【答案】(1)碱性,>;(2)中性,>;(3)酸性, < 。
【解析】
试题分析:(1)等体积等浓度两者恰好完全反应,生成醋酸钠,醋酸属于弱酸,醋酸钠属于强碱弱酸盐,CH3COO-+H2O![]() CH3COOH+OH-,水溶液显碱性,c(Na+)>c(CH3COO-);(2)根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)=c(CH3COO-),则有c(H+)=c(OH-),溶液显中性,醋酸的体积大于氢氧化钠;(3)醋酸是弱酸,醋酸的浓度大于氢氧化钠,反应后溶质为CH3COONa和CH3COOH,醋酸的电离程度大于CH3COO-的水解程度,因此溶液显酸性,c(Na+)<c(CH3COO-)。
CH3COOH+OH-,水溶液显碱性,c(Na+)>c(CH3COO-);(2)根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)=c(CH3COO-),则有c(H+)=c(OH-),溶液显中性,醋酸的体积大于氢氧化钠;(3)醋酸是弱酸,醋酸的浓度大于氢氧化钠,反应后溶质为CH3COONa和CH3COOH,醋酸的电离程度大于CH3COO-的水解程度,因此溶液显酸性,c(Na+)<c(CH3COO-)。

练习册系列答案
相关题目