题目内容
19.用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯为( )| A. | 44g | B. | 0.335mol | C. | 29.48g | D. | 0.5mol |
分析 反应的方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,46g乙醇的物质的量为$\frac{46g}{46g/mol}$=1mol,
反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,由此可知乙醇过量,则
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
1mol 1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
故选BC.
点评 本题考查化学方程式的计算,题目难度不大,注意反应的理论产率的运用以及反应方程式的书写.

练习册系列答案
相关题目
9.下列物质可以用来除去乙烷中混有的乙烯的是( )
| A. | NaOH溶液 | B. | 溴水 | C. | CCl4 | D. | H2 |
10.有机化合物A(C8H8O2)为一种无色液体,从A出发可发生如图的一系列反应.则下列说法正确的是( )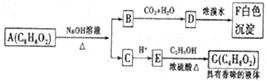

| A. | A的结构中含有碳碳双键 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有一种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | 根据图示可推知D为苯酚 |
7.下列实验操作正确且能达到预期目的是( )
| 编号 | 试验目的 | 操作 |
| ① | 比较水中氢和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与同温度的水和乙醇反应,观察反应快慢 |
| ② | 验证苯环上的氢原子能被溴原子所取代 | 向溴水中滴加苯,充分振荡,观察溴水层是否褪色 |
| ③ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中,观察溶液是否褪色 |
| ④ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②④ |
14.下列变化过程中的能量变化是将化学能转化为热能的是( )
| A. | 电解水 | B. | 酸、碱的中和反应 | ||
| C. | 冰雪融化 | D. | 绿色植物的光合作用 |
4.已知A、B、C、D、E五种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的$\frac{4}{3}$倍;A分别能与B、C、D形成电子数相等的分子X、Y、Z;E与B同主族.下列说法中不正确的是( )
| A. | Z分子中各原子共平面 | |
| B. | A、C形成的5核10电子的阳离子能破坏水的电离平衡 | |
| C. | B、E两元素的最高价氧化物对应的水化物的酸性是后者强 | |
| D. | 由X、D2、NaOH溶液和惰性电极组成的燃料电池中,负极通入的是X |
5.下列离子方程式的书写中,正确的是( )
| A. | 硫酸亚铁溶液与过氧化氢溶液混合Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 大理石溶解于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液混合:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O |
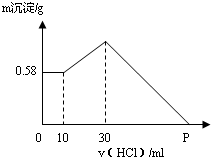 把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:
把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求: