题目内容
某研究性学习小组拟用铜屑与氧化铜混合物与由硫酸和硝酸组成的混合酸反应来制取CuSO4·5H2O晶体,混合酸中硝酸的还原产物均为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2,反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为(1)所得硫酸铜晶体的质量y为__________g(用x表示)。
(2)若x=0.4,则混合酸中HNO3与H2SO4的物质的量之比为__________。
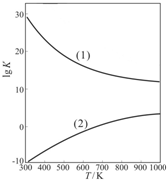
(3)若x=0.4,用
解析:(1)m(CuSO4·5H2O)=[![]() ]×
]×
(2)若x=0.4,在![]() =3 mol
=3 mol
n(CuO)=![]() =3.5 mol
=3.5 mol
依据3Cu+8H++2![]()
![]() 3Cu2++2NO↑+4H2O,所需n(HNO3)=3 mol×
3Cu2++2NO↑+4H2O,所需n(HNO3)=3 mol×![]() =2 mol
=2 mol
n(H2SO4)=3 mol+3.6 mol=6.6 mol,![]()
(3)原混合酸中m(H2SO4)=
所以w(H2SO4)=![]() ×100%=52.6%
×100%=52.6%
答案:(1)375x+ 1 500
(2)10∶33 (3)52.6%

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 (1)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.由实验现象所得出的有关Na2O2和H2O反应的结论是:
(1)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.由实验现象所得出的有关Na2O2和H2O反应的结论是: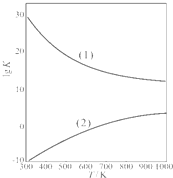 (2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m3.
(2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m3.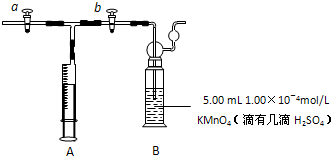
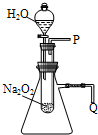 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.