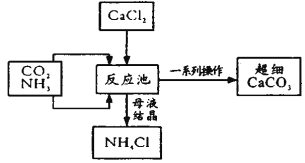
题目内容
【题目】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)A在室温下与氧气反应时生成________,D在空气中锈蚀生成的氧化物为________。
(3)写出下列化学方程式:
①A在空气中燃烧_______________________________________________________;
②B长期置于空气中变为绿色物质______________________________________________。
(4)将5 g钠铝合金投入到200 mL的水中,固体完全溶解,产生4.48 L标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为________,所得溶液中溶质的物质的量浓度为____________(假设溶液体积变化忽略不计)。
【答案】 Na Cu Al Fe Na2O Fe2O3 2Na+O2![]() Na2O2 2Cu+O2+CO2+H2O===Cu2(OH)2CO3 1∶1 0.5 mol/L
Na2O2 2Cu+O2+CO2+H2O===Cu2(OH)2CO3 1∶1 0.5 mol/L
【解析】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3,A是Na;B为紫红色固体,锈蚀时变为绿色,B是Cu;C在空气中加热熔化但不滴落,C是Al;D在氧气中燃烧,火星四射,D是Fe。
(1)根据以上分析可知四种物质的化学式分别是Na、Cu、Al、Fe。(2)钠在室温下与氧气反应时生成Na2O,铁在空气中锈蚀生成的氧化物为Fe2O3。(3)①钠在空气中燃烧的方程式为2Na+O2![]() Na2O2;②铜长期置于空气中与氧气、水和二氧化碳反应变为绿色物质的方程式为2Cu+O2+CO2+H2O=Cu2(OH)2CO3;(4)溶液中只有一种溶质,应该是NaAlO2,根据原子守恒可知钠铝合金中两种金属的物质的量之比为1∶1,物质的量均是5g÷50g/mol=0.1mol,因此所得溶液中溶质的物质的量浓度为0.1mol÷0.2L=0.5mol/L。
Na2O2;②铜长期置于空气中与氧气、水和二氧化碳反应变为绿色物质的方程式为2Cu+O2+CO2+H2O=Cu2(OH)2CO3;(4)溶液中只有一种溶质,应该是NaAlO2,根据原子守恒可知钠铝合金中两种金属的物质的量之比为1∶1,物质的量均是5g÷50g/mol=0.1mol,因此所得溶液中溶质的物质的量浓度为0.1mol÷0.2L=0.5mol/L。