��Ŀ����
����Ŀ��A��B��Ϊ���ε�ˮ��Һ��A�����ԣ�B�ʼ��Բ����������ԡ�����Ϊ���ʵ�鲽���ʵ��������ش�
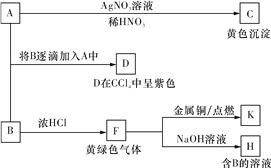
(1)д��C��D�Ļ�ѧʽ�����ʽ��__________��____________��
(2)ָ��D������Ԫ�������ڱ��е�λ��________________��ָ��K��ˮ��Һ��ϡ��Ũ����ɫ�仯________________��
(3)��SO2����ͨ��D��Һ��D��Һ��Ϊ��ɫ����������ǿ�ᡣд���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________________________________________��
(4)F��ֹ��������__________(�����ʽ)�������ʾ������ᴿ����1 100 ������������Ӧ���ɸߴ��裬д����һ���跴Ӧ�Ļ�ѧ����ʽ��_____________________________��
(5)0.25 mol F����ͨ�뺬��0.1 mol FeBr2��0.1 mol FeI2�Ļ����Һ�У���ַ�Ӧ������һ�����ӷ���ʽ��ʾ�ܷ�Ӧ��__________________________________________��
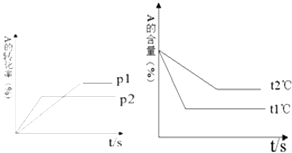
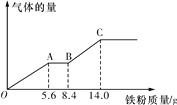
(6)ijϡ�����ϡ����Ļ����Һ100 mL������ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�9.6 gͭ�ۣ�����һ�����������ۣ�����������������������ı仯��ϵ��ͼ��ʾ(��������Ļ�ԭ����ΪNO����)����ԭ�����Һ��NO3�������ʵ���Ϊ__________����������ʵ���Ũ��Ϊ______________��
���𰸡� AgI I2 ��5���ڵڢ�A �� ����ɫ������ɫ SO2��I2��2H2O===H2SO4��2HI SiCl4 SiCl4��2H2![]() Si��4HCl 4I����4Fe2����2Br����5Cl2===2I2��4Fe3����Br2��10Cl�� 0.2 mol 5 mol/L
Si��4HCl 4I����4Fe2����2Br����5Cl2===2I2��4Fe3����Br2��10Cl�� 0.2 mol 5 mol/L
������������A�ܺ�AgNO3��Һ��Ӧ����һ��������HNO3�Ļ�ɫ��������ȷ��AΪNaI��CΪAgI������ɫ����F��Cl2��F��NaOH��Һ��Ӧ��������B������B�ʼ��Բ����������ԣ���֪BΪNaClO��NaClO����ǿ�����ԣ�������NaI������NaClO��NaI������I2���������ƺ�Ũ���ᷴӦ����������������ͭ���������Ȼ�ͭ����K���Ȼ�ͭ����
��1�������Ϸ�����֪CΪAgI��DΪI2����2����Ԫ��λ�ڵ�5���ڵڢ�A�����Ȼ�ͭˮ��Һ��ϡ��Ũ����ɫ�仯Ϊ����ɫ������ɫ����3������ǿ��Ӧ�������������ᣬ��Ӧ�ķ���ʽΪSO2��I2��2H2O��H2SO4��2HI����4��������ֹ��������SiCl4��SiCl4��������Ӧ���ɸߴ���Ļ�ѧ����ʽΪSiCl4��2H2![]() Si��4HCl����5����ԭ����I������Fe2����Br�������0.25 mol��������ͨ�뺬��0.1 molFeBr2��0.1 molFeI2�Ļ����Һ���������������ӣ���Ҫ0.1mol������Ȼ�������������ӣ���Ҫ����0.1mol��ʣ��0.05mol��������0.1mol�����ӣ�����ʣ��0.1mol�����ӣ�����ܷ�Ӧ�����ӷ���ʽΪ4I����4Fe2����2Br����5Cl2��2I2��4Fe3����Br2��10Cl������6����ͼ���֪��������������OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O���ý�������5.6g�����ʵ�����5.6g��56g/mol��0.1mol�����ݷ���ʽ��֪��������ʵ�����0.1mol��Ũ����0.1mol��0.05L��0.2mol/L������Fe��14gʱ����ȫ��Ӧ����ʱ��Һ������ΪFeSO4����Ӧ�����������ʵ���=14g��56g/mol=0.25mol�������غ��֪n��H2SO4��=n��FeSO4��=n��Fe��=0.25mol�����������Ũ����0.25mol��0.05L=5mol/L��
Si��4HCl����5����ԭ����I������Fe2����Br�������0.25 mol��������ͨ�뺬��0.1 molFeBr2��0.1 molFeI2�Ļ����Һ���������������ӣ���Ҫ0.1mol������Ȼ�������������ӣ���Ҫ����0.1mol��ʣ��0.05mol��������0.1mol�����ӣ�����ʣ��0.1mol�����ӣ�����ܷ�Ӧ�����ӷ���ʽΪ4I����4Fe2����2Br����5Cl2��2I2��4Fe3����Br2��10Cl������6����ͼ���֪��������������OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O���ý�������5.6g�����ʵ�����5.6g��56g/mol��0.1mol�����ݷ���ʽ��֪��������ʵ�����0.1mol��Ũ����0.1mol��0.05L��0.2mol/L������Fe��14gʱ����ȫ��Ӧ����ʱ��Һ������ΪFeSO4����Ӧ�����������ʵ���=14g��56g/mol=0.25mol�������غ��֪n��H2SO4��=n��FeSO4��=n��Fe��=0.25mol�����������Ũ����0.25mol��0.05L=5mol/L��

 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�����Ŀ������������͢����ȷ�����������ϵ���ǣ� ��
ѡ�� | ������ | ������ |
A | ������ǿ�������� | �ô�����Һ����ϴ���� |
B | ������ǺϽ� | ������ڳ�ʪ���������ױ���ʴ |
C | Fe2O3�Ǽ��������� | Fe2O3��������ɫ�����Ϳ�� |
D | NO2�Ǻ���ɫ���� | �����¿���ͭ��Ũ������ȡNO2 |
A.A
B.B
C.C
D.D