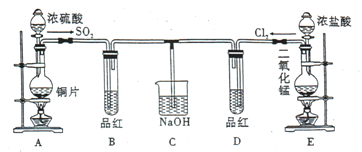
题目内容
【题目】向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( ) 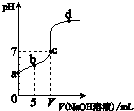
A.HA是弱酸
B.b点表示的溶液中:2c(Na+)=c(A﹣)+c(HA)
C.c点时:V=10.00mL
D.b、c、d点表示的溶液中:c(Na+)+c(H+)=c(A﹣)+c(OH﹣)
【答案】C
【解析】解:A、由图像知,0.01mol/L的HA溶液的PH值大于2,所以该酸是弱酸,故A正确; B、b点时,加入的酸的物质的量=0.01mol/L×0.01L=10﹣4 mol,碱的物质的量=0.01mol/L×0.005L=5×10﹣5 mol,该钠盐是强酸弱碱盐能水解,根据物料守恒知,n(A﹣)+n(HA)=10﹣4 mol,钠离子不水解,c(Na+)=5×10﹣5 mol,所以2c(Na+)=c(A﹣)+c(HA),故B正确.
C、该钠盐是强碱弱酸盐其溶液呈碱性,若要使溶液呈中性,酸应稍微过量,即V<10.00mL,故C错误.
D、溶液中呈电中性,溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(A﹣)+c(OH﹣),故D正确.
故选C.

练习册系列答案
相关题目