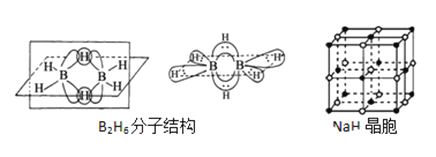
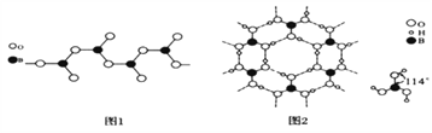
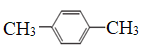
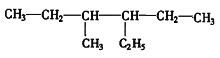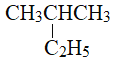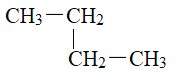��Ŀ����
����Ŀ��(1)ʪ���Ƹ��������(K2FeO4)�ķ�Ӧ��ϵ�����������ӣ�Fe(OH)3��ClO����OH����FeO42����Cl����H2O��
��д������ƽʪ���Ƹ�����ط�Ӧ�����ӷ���ʽ��______________________________
��ÿ����l mol FeO42-ת��__________mol���ӣ�����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ____mol��
�۵����£��ڸ���������Һ�м���KOH�����Ϳ������������(K2FeO4)ԭ����__��
(2)��ҵ�ϴӺ�ˮ����ȡ������ɲ������·�����
����ˮ��ͨ��Cl2����ˮ���廯�������������ӷ���ʽΪ____��
�����������Һ�д����ȿ����������ɵ��崵�����ô�����Һ���գ��仯ѧ����ʽΪ__��
�۽���������Һ��H2SO4�ữ��ʹNaBr��NaBrO3�е���ת��Ϊ�����壬�����л��ܼ���ȡ����ɵõ�����ƷNa2SO4����һ���̿��û�ѧ����ʽ��ʾΪ____��
���𰸡�2Fe(OH)3��3ClO����4OH��===2FeO42����3Cl����5H2O 3 0.15 ���¶���K2FeO4��Na2FeO4���ܽ��С Cl2��2Br��===Br2��2Cl�� 3Na2CO3��3Br2===5NaBr��NaBrO3��3CO2��6Na2CO3��3Br2��3H2O===5NaBr��NaBrO3��6NaHCO3 5NaBr��NaBrO3��3H2SO4===3Br2��3Na2SO4��3H2O
��������
(1)��ʪ���Ʊ��������(K2FeO4)����FeO42-Ϊ���Fe(OH)3Ϊ��Ӧ����ϼ������ܹ�3�ۣ��ɵ���ת���غ��֪��ClO-Ϊ��Ӧ�Cl-Ϊ��������ϼ۽���2�������ϼ�������С������Ϊ6����Fe(OH)3��ϵ��Ϊ2��FeO42-��ϵ��Ϊ2��ClO-��ϵ��Ϊ3��Cl-��ϵ��Ϊ3�����ݵ���غ��֪��OH-Ϊ��Ӧ�ϵ��Ϊ4����Ԫ���غ��֪H2OΪ�������ϵ��Ϊ5�����ӷ���ʽΪ��2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O���ʴ�Ϊ��2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
�ڷ�Ӧ��FeԪ�ػ��ϼ۱仯��+3������Ϊ+6����ÿ����1mol FeO42-ת�Ƶ��ӣ�1mol��(6-3)=3mol����ԭ����ΪCl-������Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ![]() =0.15mol���ʴ�Ϊ��3��0.15��
=0.15mol���ʴ�Ϊ��3��0.15��
�۸��¶��£�K2FeO4���ܽ�ȱ�Na2FeO4���ܽ�ȸ�С���ڸ���������Һ�м���KOH�����Ϳ������������(K2FeO4)���ʴ�Ϊ�����¶��£�K2FeO4���ܽ�ȱ�Na2FeO4���ܽ�ȸ�С��
(2)��ͨ�������������������ӷ�Ӧ���ɵ�����������ӣ������ӷ���ʽΪ��Cl2+2Br-�T2Cl-+Br2���ʴ�Ϊ��Cl2+2Br-�T2 Cl-+Br2��
�ڴ�����Һ����Br2�Ļ�ѧ����ʽΪ��3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2����6Na2CO3��3Br2��3H2O=5NaBr��NaBrO3��6NaHCO3���ʴ�Ϊ��3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2����6Na2CO3��3Br2��3H2O=5NaBr��NaBrO3��6NaHCO3��
�۽���������Һ��H2SO4�ữ��ʹNaBr��NaBrO3�е���ת��Ϊ������������ƣ��������������Ԫ�ػ��ϼ�Ϊ+5�۱��0�ۣ����ϼ۽���5�ۣ������ӻ��ϼ���-1�۵�0�ۣ����ϼ�����1�ۣ��ϼ۱仯����С������Ϊ5��������������Ӽ�����Ϊ1�������Ӽ�����Ϊ5���ٸ��ݹ۲취��ƽ����ƽ��Ӧ�Ļ�ѧ����ʽΪ��5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br 2+3H2O���ʴ�Ϊ��5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br 2+3H2O��

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�