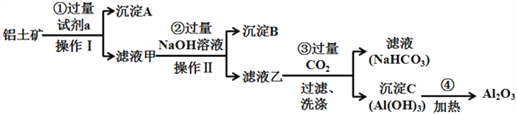
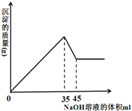
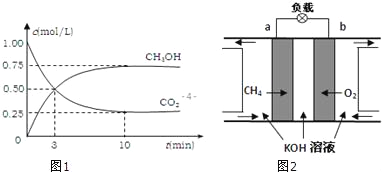
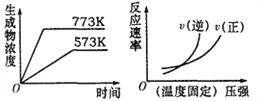
题目内容
【题目】下列物质属于酸性氧化物的是( )
A.Na2O2
B.CO
C.CaO
D.SiO2
【答案】D
【解析】解:A.Na2O2与酸反应除了生成盐和水,还生成氧气,不属于碱性氧化物,Na2O2不能和碱反应,不属于酸性氧化物,故A错误;
B.一氧化碳不是酸性氧化物也不是碱性氧化物,属于不成盐氧化物,故B错误;
C.CaO能和酸反应,属于酸性氧化物,不能和碱反应,不属于酸性氧化物,故C错误;
D.SiO2能和碱反应生成盐和水,属于酸性氧化物,故D正确;
故选D.

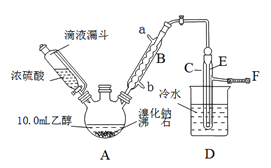
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
H2SO4(浓)+NaBr ![]() NaHSO4+HBr↑
NaHSO4+HBr↑
CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm-3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是______________。
(2)实验中用滴液漏斗代替分液漏斗的优点为_______________________。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式________________________。
(4)给A加热的目的是________________________,F接橡皮管导入稀NaOH溶液,其目的主要是___________________。
(5)图中C中的导管E的末端须在水面以下,其目的是______________________。
(6)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。从乙醇的角度考虑,本实验所得溴乙烷的产率是________________。