��Ŀ����
����Ŀ������һ������ɫ��������������������������Ҫ����;���ڻ���������Ҫ����+2��+4�ۡ�
��l���ҹ����ϸ���������������������Ҫ�ɷ�ΪSnO2���ý�̿����ԭ�����ڸ������øÿ�ʯ���Ƶô������÷�Ӧ�Ļ�ѧ����ʽΪ___________��
��2��������������Ƥ�����һ�����������������������ϵĵ缫��Ӧ��_______��
��3�������Ȼ�����SnCl2��SnCl4��SnCl2�������ͻ�ѧʵ���г��õĻ�ԭ��������ˮ�⣻SnCl4����������ɫҺ�壬�ڿ����м���ˮ�⣬�۵�-36�����е�114����
�� ��ʵ��������SnCl2��������SnCl2��Һ���Լ�����������________��
��SnCl4����������ˮ����Ũ��״�������������Ļ�����䷴Ӧ�Ļ�ѧ����ʽΪ_______��
��4��Sn(OH)2�������Ե����ԣ��ڼ�����������Sn(OH)3����ʽ���ڡ�д��Sn(OH)2������ʽ����ĵ��뷽��ʽ____________��
��5��SnS2�ǻ�ɫ���壬�׳������������H2Sͨ��SnCl4��Һ�пɵ�SnS2������д���÷�Ӧ�����ӷ���ʽ__________��
��6��ijͬѧ��������������������������·������д��Ȳⶨ���� ȡ��������ϡ�����У����ʲ����뷴Ӧ����ʹSn��ȫת��ΪSn2+���� ���˹�����Fe2(SO4)3��Һ���� ��0.10mol/LK2Cr2O7��Һ�ζ���������Cr��+3�ۣ����� �������ݼ�������۵Ĵ��ȡ������� �м���Fe2(SO4)3��������_______�������ӷ���ʽ��ʾK2Cr2O7��Һ���еζ�ʵ���ԭ��__________��
���𰸡� SnO2 + 2C![]() Sn+ 2CO Fe-2e-=Fe2+ ��SnCl2�������ڽ�Ũ�����������У�Ȼ�������ˮϡ�ͣ��������������� SnCl4+4NH3+4H2O=4NH4Cl+Sn(OH)4 Sn(OH)2+H2O
Sn+ 2CO Fe-2e-=Fe2+ ��SnCl2�������ڽ�Ũ�����������У�Ȼ�������ˮϡ�ͣ��������������� SnCl4+4NH3+4H2O=4NH4Cl+Sn(OH)4 Sn(OH)2+H2O![]() H++ Sn(OH)3- 2H2S + Sn4+=SnS2��+4H+ ��Sn2+ȫ������ΪSn4+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
H++ Sn(OH)3- 2H2S + Sn4+=SnS2��+4H+ ��Sn2+ȫ������ΪSn4+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
����������l��SnO2�ͽ�̿�ڸ������Ƶô�����CO2��CO��������Ӧ�Ļ�ѧ����ʽΪSnO2 + 2C![]() Sn+ 2CO��
Sn+ 2CO��
��2������������������绯ѧ��ʴ��Fe�������ã���Ϊ�����������ĵ缫��Ӧ��Fe-2e-=Fe2+��
��3�������Ȼ�����SnCl2��SnCl4��SnCl2�������ͻ�ѧʵ���г��õĻ�ԭ��������ˮ�⣻SnCl4����������ɫҺ�壬�ڿ����м���ˮ�⣬�۵�-36�����е�114����
�� ��SnCl2����ˮ�⣬������SnCl2��ҺʱӦ��SnCl2�������ڽ�Ũ�����������У�Ȼ�������ˮϡ�ͣ���������������������������ˮ�⣬�ַ�Sn2+��������
��SnCl4����������ˮ����Ũ��״������ˮ�����ɵ�HCl��NH3����NH4Cl��Ե�ʣ�������Ӧ�Ļ�ѧ����ʽΪSnCl4+4NH3+4H2O=4NH4Cl+Sn(OH)4 ��
��4��Sn(OH)2�������Ե����ԣ��ڼ�����������Sn(OH)3����ʽ���ڣ�˵��Sn(OH)2���ˮ�����OH-���ٽ�ˮ�ĵ��룬��Sn(OH)2������ʽ����ĵ��뷽��ʽ��Sn(OH)2+H2O![]() H++ Sn(OH)3- ��
H++ Sn(OH)3- ��
��5����H2Sͨ��SnCl4��Һ�пɵ�SnS2����������H2S��������ʲ��ɲ�֣���÷�Ӧ�����ӷ���ʽ2H2S + Sn4+=SnS2��+4H+��
��6��Sn2+��ԭ��ǿ��������ΪSn4+�������� �м���Fe2(SO4)3�������ǽ�Sn2+ȫ������ΪSn4+��K2Cr2O7��Һ������Һ��Fe2+����Cr3+��Fe3+�����ݵ���غ�͵���ת���غ㡢ԭ���غ�����ӷ���ʽΪCr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O��

����Ŀ�����ڷ��ֵ�һ����Ȼ��ʮ������������Al��Cu.Fe���ֽ���Ԫ����ɣ��ش��������⣺
��1����ͭԪ��λ�����ڱ���_____����Cu2+���ӵļ۲�����ʾʽΪ____��
���̡�����������Ԫ�ص����������±���
������/KJ/mol | I1 | I2 | I 3 | I4 |
Mn | 717.3 | 1509.0 | 3248 | 4940 |
Fe | 762.5 | 1561.9 | 2957 | 5290 |
Co | 760.4 | 1648 | 3232 | 4950 |
��Ԫ�صĵ������������Ե�����Ԫ�غ���Ԫ�أ���ԭ����____��
��ʵ���ҿ��ó�Ѫ��K3[Fe(CN)6]����Fe2+���ӣ��ڳ�Ѫ������Ԫ�صĻ��ϼ�Ϊ____���������ӵ���λ��Ϊ______��
��2�����÷�Ӧ��X+C2H2+NH3��Cu2C2+NH4Cl(δ��ƽ)�ɼ�����Ȳ��
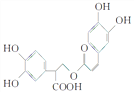
�ٻ�����X�����ṹ��ͼ���ݴ˿�֪X�Ļ�ѧʽΪ_______��
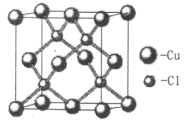
����Ȳ�����ЦҼ���м���Ŀ֮��Ϊ______��̼ԭ�ӵ��ӻ���ʽΪ_______��NH4+�ռ乹��Ϊ______����������������
��3�����������ֻ�����a��AlCl3 b��NaCl c��Al2O3�е��ɸߵ���������_______�����ţ�����ԭ����____________��
��Al������ԭ�Ӳ�ȡ�����������ܶѻ����侧���߳�Ϊ0.405nm����ʽ��ʾAl���ʵ��ܶ�_______g/cm3�����ؼ�����������