题目内容
【题目】下列反应中符合下图图象的是( )
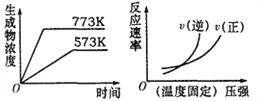
A. N2(g) +3H2(g)![]() 2NH3(g) ;△H=—Q1kJ·mol—1(Q1>0)
2NH3(g) ;△H=—Q1kJ·mol—1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ;△H=+Q2kJ·mol—1(Q2>0)
2SO2(g)+O2(g) ;△H=+Q2kJ·mol—1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=—Q3kJ·mol—1(Q3>0)
4NO(g)+6H2O(g);△H=—Q3kJ·mol—1(Q3>0)
D. H2(g) +CO(g)![]() C(s)+H2O(g);△H=+Q4kJ·mol—1(Q4>0)
C(s)+H2O(g);△H=+Q4kJ·mol—1(Q4>0)
【答案】B
【解析】
A.气体反应物的化学计量数之和大于气体生成物的化学计量数之和,且为放热反应,故A错误;B.气体反应物的化学计量数之和小于气体生成物的化学计量数之和,且正反应为吸热反应,故B正确;C.反应为放热反应,故C错误;D.气体反应物的化学计量数之和小于气体生成物的化学计量数之和,故D错误;答案为B。

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目