题目内容
20.几种物质的溶度积常数见下表:| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)过滤后,将所得滤液经过蒸发浓缩,冷却结晶操作,可得到CuCl2•2H2O晶体.
(3)由CuCl2•2H2O晶体得到纯的无水CuCl2,需要进行的操作是在HCl气氛中加热.
(4)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL.(已知:I2+2S2O32-═S4O62-+2I-.)
①可选用淀粉作滴定指示剂,滴定终点的现象是淀粉由蓝色变成无色且半分钟不变化.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为85.5%.
分析 (1)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=$\frac{{K}_{sp}[Fe(OH)_{3}]}{{c}^{3}(O{H}^{-})}$计算铁离子浓度;
(2)根据溶液蒸发结晶得到晶体分析;
(3)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(4)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,发生反应离子方程式计算分析.
解答 解:(1)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是氧化铜或氢氧化铜或碱式碳酸铜,溶液的pH=4,所以溶液中氢离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}[Fe(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{2.6×1{0}^{-39}}{(1×1{0}^{-10})^{3}}$=2.6×10-9mol/L,
故答案为:CuO或Cu(OH)2或Cu2(OH)2CO3 ;2.6×10-9mol/L;
(2)将所得氯化铜滤液经过蒸发浓缩、冷却结晶,才能得到CuCl2•2H2O晶体,故答案为:蒸发浓缩;冷却结晶;
(3)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体;想得到无水CuCl2的合理方法是,让CuCl2•2H2O晶体在干燥的HCl气流中加热脱水,
故答案为:在干燥的HCl气流中加热;
(4)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL,反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点为蓝色褪去一段时间不恢复颜色,
故答案为:淀粉溶液;淀粉由蓝色变成无色且半分钟不变化;
②CuCl2溶液与KI反应的离子方程式为:2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0400L 0.1000mol/L×0.0400L=0.004mol
试样中CuCl2•2H2O的质量百分数=$\frac{0.004mol×171g/mol}{0.800g}$×100%=85.5%,
故答案为:85.5%.
点评 本题考查Ksp计算和物质制备,沉淀溶解平衡的分析应用,滴定实验的原理应用,滴定过程的反应原理和计算方法是解本题的关键,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 与稀H2SO4共热,生成2种有机物 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
| A. | 以FeCl3溶液区分KSCN、苯酚、NaOH、乙醇、AgNO3的水溶液 | |
| B. | 在含有少量苯酚的苯中加入足量浓溴水,过滤,以除去苯酚 | |
| C. | 溴乙烷中的乙烯可经过水洗分液后除去 | |
| D. | 乙酸乙酯中的乙酸可先加NaOH溶液、然后分液除去 |
| A. | 920kJ | B. | 557kJ | C. | 188kJ | D. | 436kJ |
| A. | 甲烷的球棍模型: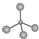 | B. | (CH3)3COH的名称:2,2二甲基乙醇 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 羟基的电子式: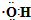 |
| A. | 互为同系物的有机物其组成元素相同,且结构必须相似 | |
| B. | 分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14 n(n为正整数) |
| A. | 纯碱NaOH,食盐NaCl | B. | 小苏打Na2CO3,苛性钠NaOH | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 胆矾CuSO4•5H2O,消石灰Ca(OH)2 |
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.