题目内容
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
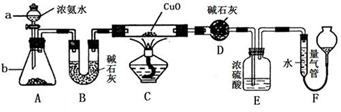
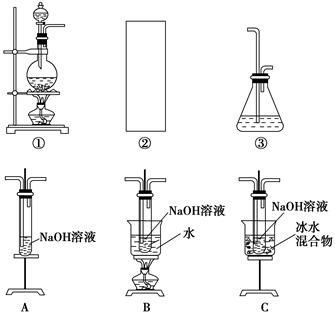
(1)用图所示装置制取Na2S2O3,其中NaOH溶液的作用是 。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。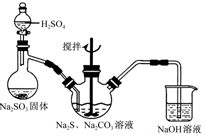
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示剂,滴定终点的现象是 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的质量分数会 (填“偏高”、“偏低”或“不变”)。
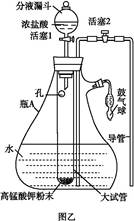
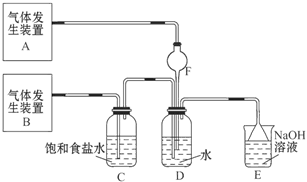
(3)本实验对Na2S的纯度要求较高,利用图所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为: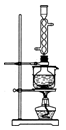
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
(1)吸收SO2尾气,防止污染空气 NaCl(或S,或NaCl、S)
(2)①IO3-+5I-+6H+= 3I 2+3H2O 淀粉
②溶液由无色变为蓝色,且半分钟内不褪色
③偏低
(3)将所得滤液冷却结晶,过滤
解析试题分析:(1)实验中使用污染性气体SO2,防止其逸出污染空气,故用碱液吸收;浓盐酸引入了氯离子,故有NaCl杂质,还可能有硫元素的归中反应产物S;(2)①发生归中反应,IO+5I-+6H+=3I2+3H2O;有碘单质参与或生成的反应均用淀粉做指示剂;实验是用碘溶液滴定Na2S2O3·溶液,滴定前溶液为无色,滴定终点后碘与淀粉显蓝色,且要保证试剂充分反应故应让现象半分钟内不褪色;③该现象会有Na2S2O3没反应完全,导致碘标准液量偏少,计算出Na2S2O3也偏少,结果偏低;(3)根据信息提示Na2S提纯应在温度高的情况下溶解于酒精,趁热过滤除去杂质,然后冷却结晶过滤洗涤干燥得到纯净的产品。
考点:考查综合实验物质的制备与分析有关问题。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。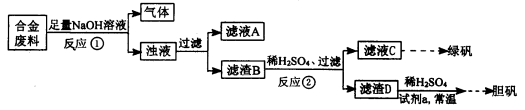
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
②滤渣B中Fe的质量分数为____%(精确到0.1%)。