题目内容
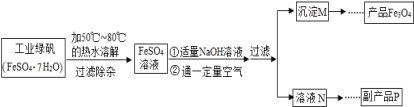
【题目】同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]
[查阅资料]
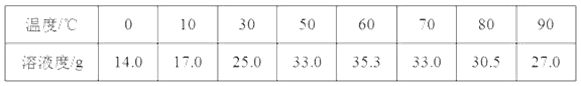
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2=4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是______________。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式_____________。
(3)上述过程中,要控制“通一定量空气”的目的是____________。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为___。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→______→______→d。
a.过滤b.加热浓缩c.冷却结晶d.晶体加热至完全失去结晶水
【答案】在50 ℃~80 ℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4 防止氢氧化亚铁完全转化为氢氧化铁 90∶214(或45∶107) c a
【解析】
根据工艺流程图及题干信息中温度与溶解度间的关系分析解答;根据物质信息分析书写相关反应方程式;根据硫酸钠的物理性质分析从溶液中得到硫酸钠的操作顺序。
(1)根据图表中的信息可知,在50 ℃至80℃的热水中,硫酸亚铁的溶解度较大,利于溶解更多的硫酸亚铁,提高产率,故答案为:在50 ℃~80 ℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率;
(2)氢氧化钠和硫酸亚铁反应生成氢氧化亚铁和硫酸钠,反应方程式为:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4;
(3)上述过程中,要控制“通一定量空气”的目的是控制氢氧化亚铁转化为氢氧化铁的量,故答案为:防止氢氧化亚铁完全转化为氢氧化铁;
(4)要使四氧化三铁的产率最高,上述流程中产生的氢氧化亚铁与氢氧化铁的物质的量之比为1∶2,最佳质量比为90∶214(或45∶107);
(5)根据硫酸钠晶体的溶解度随温度的升高而增大,采用加热浓缩、冷却结晶的方法,再过滤,晶体加热至完全失去结晶水,得到硫酸钠,故答案为:c;a。