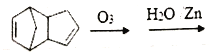题目内容
【题目】将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况,忽略N2O4),则反应中消耗HNO3的物质的量为
A. 1molB. 0.05molC. 1.05molD. 0.11mol
【答案】D
【解析】
Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,说明还原产物是NO、NO2;n(Cu)=![]() 0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算消耗硝酸的物质的量。
0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算消耗硝酸的物质的量。
n(Cu)=![]() 0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据原子守恒得生成硝酸铜需要的n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.03mol=0.06mol,气体为氮氧化物,气体的物质的量=n(NO)+n(NO2)=
0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据原子守恒得生成硝酸铜需要的n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.03mol=0.06mol,气体为氮氧化物,气体的物质的量=n(NO)+n(NO2)=![]() 0.05mol,根据N元素守恒可知共消耗硝酸的物质的量为:0.06mol+0.05mol=0.11mol,故选D。
0.05mol,根据N元素守恒可知共消耗硝酸的物质的量为:0.06mol+0.05mol=0.11mol,故选D。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目