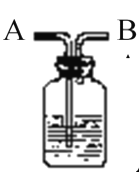
题目内容
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
【答案】b、c 酸式滴定管 偏大 锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪色 0.5500
【解析】
(1)加水稀释、加入和醋酸反应的物质或加热都能促进醋酸的电离;
(2)①白醋的主要成分为CH3COOH,可用酸式滴定管量取;
②碱式滴定管没有润洗,导致标准液浓度减小,滴定时消耗标准液的体积偏大;
③用酚酞作指示剂,滴定终点前为无色,达到滴定终点时溶液变为浅红色,据此判断滴定终点的现象;
④三次滴定数据均有效,计算出消耗标准液的平均体积,然后结合c(醋酸)=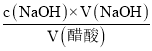 计算。
计算。
(1)加水稀释、加入和醋酸反应的物质或加热都能促进醋酸的电离,因此加入盐酸或醋酸钠都发生同离子效应而抑制醋酸的电离,因此正确的是b、c;
(2)①白醋的主要成分为CH3COOH,可用酸式滴定管量取;
②碱式滴定管没有润洗,导致标准液浓度减小,滴定时消耗标准液的体积偏大,导致测定结果比准确值偏大;
③用酚酞作指示剂,滴定终点前为无色,达到滴定终点时溶液变为浅红色,因此达到滴定终点时,锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪色;
④三次滴定数据均有效,消耗标准液的平均体积为![]() =22.00ml,那么该白醋样品中醋酸总酸度为c(醋酸)=
=22.00ml,那么该白醋样品中醋酸总酸度为c(醋酸)=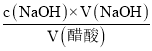 =
=![]() =0.5500mol/L。
=0.5500mol/L。

【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0