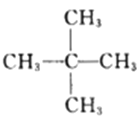
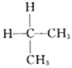
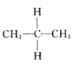
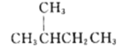��Ŀ����
����Ŀ��a��b��c��d��e���ֶ�����Ԫ�ص�ԭ������������aΪ�ǽ���Ԫ�أ���a��eͬ���壬c��dΪͬ���ڵ�����Ԫ�ء�eԭ�ӵ�����������c��dԭ������������֮�͡�bԭ���������������ڲ��������2����c����̬�⻯���������3�����ۼ������ƶϣ�
��1��д��bԪ�������ڱ��е�λ��__________��
��2��д��һ����a��c��d���γɵ����ӻ�����__________ (��ѧʽ)������e������������Ӧˮ�������Һ����ʱ��Ӧ�����ӷ���ʽ��_____________________��
��3��c�ĵ��ʵĵ���ʽΪ__________��
��4��b��d��ȣ��ǽ����Խ�ǿ����__________ (��Ԫ�ط��ű�ʾ)��������ʵ��֤����һ���۵���___(ѡ����ĸ���)��
A�������£���ĵ��ʳʹ�̬����ĵ��ʳ���̬
B������⻯����ȶ���ǿ�ڣ���⻯��
C��������γɵĻ������У��������
D������⻯��ķе���ڣ���⻯��
���𰸡��ڶ����ڢ�A�� NH4NO3 NH4++OH��![]() NH3��+H2O
NH3��+H2O ![]() O BC
O BC
��������
a��b��c��d��e���ֶ�����Ԫ�ص�ԭ������������bԭ���������������ڲ��������2����ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����bΪCԪ�أ�c���⻯���������3�����ۼ�����c���ڢ�A�壬c��dΪͬ���ڵ�����Ԫ�أ�d���ڢ�A�壬eԭ�ӵ�����������c��dԭ������������֮�ͣ���e��������=5+6=11����eΪNa��aΪ�ǽ���Ԫ�أ���a��eͬ���壬��aΪHԪ�أ����ԭ��������֪��c��dֻ�ܴ��ڵڶ����ڣ���cΪNԪ�ء�dΪOԪ�أ��ݴ˽��
��1��bΪCԪ�أ��������ڱ��еڶ����ڢ�A�壬�ʴ�Ϊ���ڶ����ڢ�A�壻
��2����H��N��O�γɵ����ӻ�����Ϊ��NH4NO3��e������������Ӧˮ����ΪNaOH������������Һ��������ڼ��������·������ӷ�Ӧ���ɰ�����ˮ����Ӧ���ӷ���ʽΪNH4++OH-![]() NH3��+H2O���ʴ�Ϊ��NH4NO3��NH4++OH-
NH3��+H2O���ʴ�Ϊ��NH4NO3��NH4++OH-![]() NH3��+H2O��
NH3��+H2O��
��3��c�ĵ���ΪN2��������Nԭ��֮���γ�3�Թ��õ��Ӷԣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4��bΪ̼Ԫ�ء�dΪ��Ԫ�أ�C��Oͬ���ڣ���ԭ����������ǽ�������ǿ���ʷǽ�����O��C��A�����ʵ�״̬�����������ʣ����ܱȽϷǽ����ԣ���A����B��d���⻯����ȶ���ǿ��b���⻯�˵���ǽ�����dǿ����B��ȷ��C��b��d�γɵĻ������У�b�����ۣ�˵��d�Լ��ϵ��ӵ�������ǿ����d�ķǽ����Ը�ǿ����C��ȷ��D���е������������ʣ����ܱȽϷǽ�����ǿ������D���ʴ�Ϊ��O��BC��