题目内容
【题目】用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
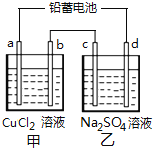
A.d极为阴极
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C.若利用甲池精炼铜,b极应为粗铜
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L标准状况下
【答案】C
【解析】
A.电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,说明c电极c(OH-)增大,溶液中H+放电,则c电极是阴极、d电极是阳极,A错误;
B.原电池放电时,正极反应式为PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l),负极为Pb+SO42--2e-=PbSO4,B错误;
C.根据选项A分析可知c电极是阴极、d电极是阳极,则b是阳极,a是阴极。电解精炼粗铜时,粗铜作阳极,所以b电极为粗铜,C正确;
D.电解析出6.4gCu,其物质的量n(Cu)=6.4g÷64g/mol=0.1mol,转移电子的物质的量是0.2mol电子,则在乙池中,阴极c电极上发生反应2H++2e-=H2↑,反应生成0.1mol氢气、d电极上发生反应:4OH--4e-=2H2O+O2↑,生成0.05molO2,在甲池的b电极上析出0.1molCl2,所以两个电池中反应产生的气体的总物质的量是0.1mol+(0.1mol+0.05mol)=0.25mol,故生成气体体积=0.25mol×22.4L/mol=5.6L,D错误;
故合理选项是C。