题目内容
【题目】I.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是_______________________。
(2)加入乙醇的作用是_____________________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____________, 该晶体中配体分子的空间构型为_______________________。(用文字描述)
II.含![]() 、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
(1) 在K3[Fe(CN)6]中中心离子是________,配体是_________,配位数是_________。
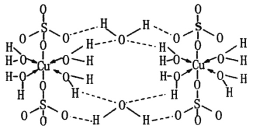
(2)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:
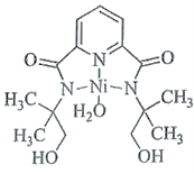
①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键。_____
的配位键。_____
(3) Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为__________________。
(4)![]() 的酸性强于
的酸性强于![]() 的原因是_________________________________________。
的原因是_________________________________________。
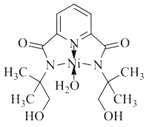
【答案】[Cu(H2O)4]2+ 降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度 Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH- 配位键(或共价健) 三角锥形 Fe3+ CN— 6 ![]()
![]()
 As>Se>Ge
As>Se>Ge ![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强
酸性更强
【解析】
I.由信息可知,溶于水后加氨水发生Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,再加入乙醇溶剂,将析出深蓝色的晶体为Cu(NH3)4SO4H2O。
II.(1)根据配合物K3[Fe(CN)6结构分析,含有空轨道的金属阳离子为中心离子,有孤对电子的原子或离子为配体,配位数就是配体的个数;
(2)根据结构式可知,N原子价电子对数为3、4,所以杂化方式为sp2、sp3;N、O提供孤电子对;
(3)同周期,从左到右,第一电离能增大,As的价电子排布式为:4s24p3,p轨道半充满状态,较稳定,第一电离能最大,据此判断第一电离能大小;
(4)![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多或
多或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,据此判断酸性强弱。
中的O的电子向As偏移,据此判断酸性强弱。
I.(1)溶液中呈天蓝色微粒的化学式是[Cu(NH3)4]2+,故答案为:[Cu(NH3)4]2+;
(2)加入乙醇的作用是降低溶剂的极性,减小Cu(NH3)4SO4H2O的溶解度,故答案为:降低溶剂的极性,减小Cu(NH3)4SO4H2O的溶解度;
(3)蓝色沉淀溶解成深蓝色溶液的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(4)Cu(NH3)4SO4H2O中Cu2+与NH3之间的化学键由Cu2+提供空轨道,N原子提供电子对,为配位键(或共价健);配体分子为氨,空间构型为三角锥形,故答案为:配位键(或共价健);三角锥形。
II.(1)根据配合物K3[Fe(CN)6结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Fe3+、有孤对电子的原子或离子为配体,所以配体为CN、配位数就是配体的个数,所以配位数为6,故答案为:Fe3+;CN;6;
(2)①价电子对数=![]() 键+孤电子对数,根据结构式可知,N原子的价电子对数为:3、4,其杂化方式为sp2、sp3,故答案为:sp2;sp3;
键+孤电子对数,根据结构式可知,N原子的价电子对数为:3、4,其杂化方式为sp2、sp3,故答案为:sp2;sp3;
②N、O提供孤电子对,所以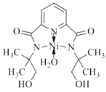 ,故答案为:
,故答案为: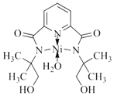 ;
;
(3)同周期,从左到右,第一电离能增大,As的价电子排布式为:4s24p3,p轨道半充满状态,较稳定,第一电离能最大,则第一电离能为:As>Se>Ge,故答案为:As>Se>Ge;
(4)![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强或
的酸性强或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强,故答案为:
酸性更强,故答案为:![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强。
酸性更强。

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案