题目内容
【题目】草酸钴可用于制备有机合成中间体。一种以铜钴矿为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程如图:

已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co2+、SO42-;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③25℃时,Ksp[Co(OH)2]=1.6×10-15。
(1)①生产时为提高铜钴矿粉浸出率,常采取的措施有___(填字母)。
a.高温浸出 b.适当延长浸出时间 c.分批加入细菌浸取液并搅拌
②铜钴矿粉也可采用在90℃、酸性条件下,加入适当还原剂进行浸出。若用Na2SO3为还原剂,浸出钴的主要化学反应为Co2O3+2H2SO4+Na2SO3![]() 2CoSO4+2H2O+Na2SO4。除考虑成本因素外,还原剂不选用浸出率更高的NaNO2的原因是___。
2CoSO4+2H2O+Na2SO4。除考虑成本因素外,还原剂不选用浸出率更高的NaNO2的原因是___。
(2)“萃取”步骤中萃取除去的主要金属阳离子是___。
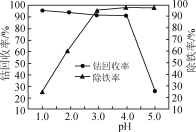
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
①“氧化”过程的离子方程式为___。
②pH为4~5时,钴的回收率降低的原因是___。
(4)300℃时,在空气中煅烧CoC2O4·2H2O可制得CO3O4,该反应的化学方程式为___。
【答案】bc 90℃、酸性条件下,还原剂选用NaNO2会产生大量的有毒气体NO2 Cu2+ 2Fe2++H2O2+2H2O![]() 2FeOOH+4H+ pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低 3CoC2O4·2H2O+2O2
2FeOOH+4H+ pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低 3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O
Co3O4+6CO2+6H2O
【解析】
铜钴矿粉加入细菌浸取液后,溶液中的离子有H+、Fe3+、Cu2+、Co2+、SO42-,用萃取剂出去Cu2+,加还原剂将Fe3+还原为Fe2+,然后加入H2O2将Fe2+氧化为FeOOH沉淀,除去Fe,最后再用C2O42-将Co2+沉淀下来,得到CoC2O4。
(1)①a.高温条件下可以加快反应速率,但是细菌在高温条件下会死亡,故不能用高温,a错误;
b. 适当延长浸出时间可以使反应更充分,提高浸出率,b正确;
c. 分批加入细菌浸取液并搅拌能使反应物混合更均匀,更充分,提高浸出率,c正确;
故选bc。
②NaNO2被氧化后会生成NO2,有毒,造成环境污染,故不能使用NaNO2;
(2)由分析可知,后续的操作不能除去Cu2+,故只能在萃取步骤中除去;
(3)①根据流程的提示,氧化剂为H2O2,氧化后产物为FeOOH,故反应为:2Fe2++H2O2+2H2O![]() 2FeOOH+4H+,
2FeOOH+4H+,
②根据提示,pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成较多的胶体,氧化铁胶体吸附大量Co2+,导致钴回收率降低;
(4)根据题意,在空气中煅烧CoC2O4·2H2O可制得Co3O4,Co、C化合价升高,空气中的O2参与反应,方程式为:3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O;
Co3O4+6CO2+6H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案