题目内容
【题目】化学能与电能可相互转化,根据下图回答问题。
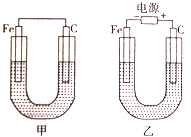
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
【答案】碳 铁 4OH--4e-=O2↑+2H2O或2H2O-4e- = O2↑+ 4H+ 还原反应 2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH 0.1mol/L
Cl2↑+H2↑+2NaOH 0.1mol/L
【解析】
(1)甲为原电池,Fe为负极,乙为电解池,Fe为阴极,据此分析判断;②乙中阳极上氢氧根离子放电,据此分析书写电极反应式;
(2)①甲中碳为正极;②电解NaCl溶液生成NaOH、氢气、氯气;③根据②的反应方程式分析解答。
(1)①甲为原电池,Fe为负极,总反应为Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O或2H2O-4e- = O2↑+ 4H+,故答案为:4OH--4e-=O2↑+2H2O或2H2O-4e- = O2↑+ 4H+;
(2)①甲中碳为正极,正极上氧气得电子发生还原反应,故答案为:还原反应;
②电解NaCl溶液生成NaOH、氢气、氯气,反应的化学方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
③根据2Cl-+2H2O ![]() 2OH-+H2↑+Cl2↑知,c(OH-)=
2OH-+H2↑+Cl2↑知,c(OH-)=![]() ×2=0.1mol/L,故答案为:0.1mol/L。
×2=0.1mol/L,故答案为:0.1mol/L。