题目内容
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。

i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________________________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. 100mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是____________________________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________;操作Ⅰ的名称是___________。
iii纯度测定
(4)称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应).重复三次,平均每次消耗KOH溶液的体积23.00mL。样品中苯甲酸纯度为_______。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物。应采用___________法对样品提纯。
【答案】a 平衡压强,使甲苯顺利滴入三颈烧瓶 B 便于控制温度和使容器受热均匀 蒸馏 分液 92% 重结晶
【解析】
(1)根据逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体体积约为55mL,不超过容器的2/3,所以选择100mL的三颈烧瓶,故选B;沸水浴加热便于控制温度和使容器受热均匀;
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;
(4)苯甲酸与KOH反应为:![]() +KOH
+KOH![]() +H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
+H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
(5)分离溶解度差距较大的两种溶质通常采用重结晶的方法,答案为重结晶;
(1)根据逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶,故答案为:a;平衡压强,便于甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体体积约为55mL,不超过容器的2/3,所以选择100mL的三颈烧瓶,故选B;沸水浴加热便于控制温度和使容器受热均匀,故答案为:B;便于控制温度和使容器受热均匀;
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体,故答案为:蒸馏;分液;
(4)苯甲酸与KOH反应为:![]() +KOH
+KOH![]() +H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
+H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
(5)分离溶解度差距较大的两种溶质通常采用重结晶的方法,答案为重结晶;

 阳光课堂课时优化作业系列答案
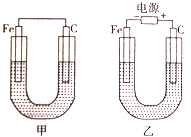
阳光课堂课时优化作业系列答案【题目】某兴趣小组进行电解原理的实验探究,实验如下:一定温度下,以铜为电极,按如图所示装置电解饱和食盐水,通电2min。实验现象:接通电源30s内,阳极附近出现白色浑浊,之后变为橙黄色浑浊,此时测定溶液的pH约为10。结束后(温度不变),试管底部聚集大量红色沉淀,溶液仍为无色。

查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
下列说法错误的是( )
A. 反应结束后,最终溶液一定呈碱性
B. 反应过程中发生了沉淀转化,说明Ksp(CuOH)<Ksp (CuCl)
C. 阴极的电极反应式为2H2O+2e-=H2↑+2OH-
D. 电解过程中,Cl-移向阳极