题目内容
【题目】一定温度下,探究铜与稀HNO3的反应过程如图:
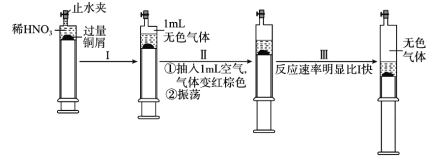
下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
【答案】B
【解析】
A.过程Ⅰ发生的反应为Cu和稀HNO3的反应,离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,故A正确;
B.随着反应的进行,溶液里生成硝酸铜,根据氮元素守恒,溶液中c(HNO3)应比原硝酸浓度减小,不会增大,故B错误;
C.加入NO2后反应速率加快,说明NO2对该反应具有催化剂,故C正确;
D.反应停止后,滴加稀硫酸,溶液中的NO3-在酸性条件下有强氧化性,可继续溶解铜,故D正确;
故答案为B。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】乙二酸俗称草酸,是一种二元弱酸(结构简式为HOOC﹣COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式_____________
(2)KHC2O4溶液显酸性的原因是___________
(3)向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是________。
A.c(K+)═ c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)
B.c(Na+)═ c(H2C2O4)+c(C2O42﹣)
C.c(K+)+c(Na+)═ c(HC2O4﹣)+c(C2O42﹣)
D.c(K+)>c(Na+)