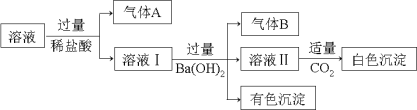
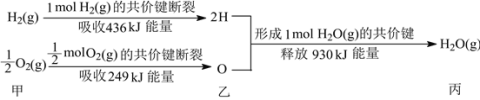
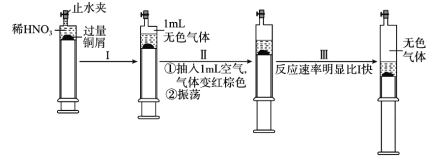
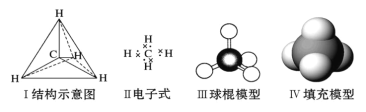
��Ŀ����
����Ŀ���Ҷ����׳Ʋ��ᣬ��һ�ֶ�Ԫ���ᣨ�ṹ��ʽΪHOOC��COOH���ɼ�дΪH2C2O4��������һ����Ҫ�Ļ���ԭ�ϡ���������0.01mol/L��H2C2O4��KHC2O4��K2C2O4��Һ��pH�����ʾ����գ�
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
��1��д��H2C2O4�ĵ��뷽��ʽ_____________
��2��KHC2O4��Һ�����Ե�ԭ����___________
��3����0.1mol/L�IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����________��
A��c��K+���T c��HC2O4����+c��H2C2O4��+c��C2O42����
B��c��Na+���T c��H2C2O4��+c��C2O42����
C��c��K+��+c��Na+���T c��HC2O4����+c��C2O42����
D��c��K+����c��Na+��
���𰸡�H2C2O4![]() H++HC2O4����HC2O4��
H++HC2O4����HC2O4��![]() H++C2O42�� HC2O4���ĵ���̶ȴ���ˮ��̶� AD
H++C2O42�� HC2O4���ĵ���̶ȴ���ˮ��̶� AD
��������
��1��������0.01mol��L��1��H2C2O4��Һ��pHΪ2.1��KHC2O4����pHΪ3.1��˵�������Ƕ�Ԫ���
��2��HC2O4�����ܹ�����Ҳ�ܹ�ˮ�⣬KHC2O4��Һ�����ԣ�˵��HC2O4���ĵ���̶ȴ���ˮ��̶ȣ�
��3��A�����������غ��жϣ�
B�����ݵ���غ��жϣ�
C�����������غ㡢����غ��жϣ�
D����ǡ�÷�Ӧ��c��K����=c��Na��������ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ��
��1����Ԫ����ֲ����룬������뷽��ʽΪ�� H2C2O4![]() H++HC2O4����HC2O4��
H++HC2O4����HC2O4��![]() H++C2O42����
H++C2O42����
��2��HC2O4�����ܹ�����Ҳ�ܹ�ˮ�⣬KHC2O4��Һ�����ԣ�˵��HC2O4���ĵ���̶ȴ���ˮ��̶ȣ�
��3��A��̼Ԫ������Һ�д�����ʽ�У�HC2O4����H2C2O4��C2O42�������������غ���c��K����=c��HC2O4����+c��H2C2O4��+c��C2O42��������A��ȷ��
B�����ݵ���غ��У�c��K����+c��Na����+c��H����=c��HC2O4����+2c��C2O42����+c��OH��������Һ�����ԣ���c��H����=c��OH��������c��K����+c��Na����=c��HC2O4����+2c��C2O42��������B����
C����c��K����=c��HC2O4����+c��H2C2O4��+c��C2O42������c��K����+c��Na����=c��HC2O4����+2c��C2O42������֪��c��Na����=c��C2O42����-c��H2C2O4������C����
D����ǡ�÷�Ӧ��c��K����=c��Na��������ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ����c��K������c��Na��������D��ȷ��
��ѡAD��

����Ŀ���±����е������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�(��֪���ԭ�Ӱ뾶Ϊ0.089nm)��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | ��2 | ��3 | ��6����2 | ��1 | ��2 |
(1)�Ƚ�A��B��E����Ԫ�صļ����ӵ����Ӱ뾶��С___(�ö�ӦԪ�����ӷ��ű�ʾ)��
(2)AԪ�ؼ����ӵĽṹʾ��ͼΪ__��BԪ��λ�����ڱ��е�__����__�塣
(3)B������������Ӧˮ������C������������Ӧˮ���ﷴӦ�����ӷ���ʽΪ__��
(4)��������Ԫ�ص�����������Ӧˮ������������ǿ����__(�ѧʽ)��
(5)C��E�γɵĻ�����Ϊ__(�ѧʽ)��
(6)�õ���ʽ��ʾA��D�γɻ�����Ĺ���___��