题目内容
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:
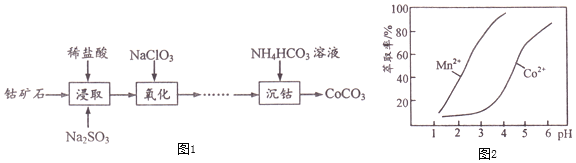
下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]() 已知金属萃取剂对金属离子的萃取率与pH的关系如图2所示。请补充完整由“氧化”后的溶液制备
已知金属萃取剂对金属离子的萃取率与pH的关系如图2所示。请补充完整由“氧化”后的溶液制备![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入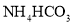 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。
【答案】![]()
![]() 、
、![]() 与
与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() 水浴加热 温度过高
水浴加热 温度过高![]() 易分解,温度过低反应速率缓慢
易分解,温度过低反应速率缓慢 ![]() 溶液,调节溶液的pH至
溶液,调节溶液的pH至![]() ,过滤,向滤液中加入稀盐酸调pH至
,过滤,向滤液中加入稀盐酸调pH至![]() 左右,加入金属萃取剂萃取
左右,加入金属萃取剂萃取![]() 次,静置后分液,得较纯
次,静置后分液,得较纯![]() 溶液
溶液
【解析】
用钴矿石![]() 含
含![]() 、
、![]() 及少量
及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() ,钴矿石加入稀盐酸和亚硫酸钠,铁离子和二氧化锰被亚硫酸钠还原得到亚铁离子和锰离子,加入氯酸钠氧化亚铁离子为铁离子,氧化后的溶液中加入碳酸钠溶液调节溶液的pH至
,钴矿石加入稀盐酸和亚硫酸钠,铁离子和二氧化锰被亚硫酸钠还原得到亚铁离子和锰离子,加入氯酸钠氧化亚铁离子为铁离子,氧化后的溶液中加入碳酸钠溶液调节溶液的pH至![]() ,沉淀铁离子和氯离子,过滤,向滤液中加入稀盐酸调pH至
,沉淀铁离子和氯离子,过滤,向滤液中加入稀盐酸调pH至![]() 左右,滤液中加入萃取剂的作用是除去锰离子,根据图像可知,调节溶液PH在
左右,滤液中加入萃取剂的作用是除去锰离子,根据图像可知,调节溶液PH在![]() 之间,可以除去Co2+中的Mn2+,加入
之间,可以除去Co2+中的Mn2+,加入![]() 溶液沉钴得
溶液沉钴得![]() 。
。
![]() “浸取”步骤
“浸取”步骤![]() 发生反应是在酸溶液中和亚硫酸钠反应生成硫酸钴和水,反应的离子方程式为:
发生反应是在酸溶液中和亚硫酸钠反应生成硫酸钴和水,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 浸取”步骤
浸取”步骤![]() 能还原
能还原![]() ,氧化铁和二氧化锰也具有氧化性,能和
,氧化铁和二氧化锰也具有氧化性,能和![]() 发生氧化还原反应,故钴矿石中还能被
发生氧化还原反应,故钴矿石中还能被![]() 还原的物质有:
还原的物质有:![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() ;
;
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是:酸性条件下ClO3-与
的用量过多会造成的不良后果是:酸性条件下ClO3-与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() ,
,
故答案为:与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() ;
;
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为:水浴加热,温度控制在
条件下进行,适宜的加热方式为:水浴加热,温度控制在![]() 的原因是温度过高碳酸氢铵会分解,温度过低反应速率慢,
的原因是温度过高碳酸氢铵会分解,温度过低反应速率慢,
故答案为:水浴加热;温度过高![]() 易分解,温度过低反应速率缓慢;
易分解,温度过低反应速率缓慢;
![]() 氧化后的溶液中含有Fe3+、Al3+、Mn2+、Co2+、Na+、Cl-、SO42-等离子,可以通过调节溶液的PH除去Fe3+和Al3+,根据金属离子沉淀的PH范围的表格可知需要控制溶液的PH在5.2到7.6之间,使Fe3+、Al3+完全沉淀而Co2+不沉淀。Mn2+不能通过调节溶液的PH的方法除去,根据金属萃取剂对金属离子的萃取率与pH的关系图像可知,Mn2+可以用萃取的方法除去,在PH在3.5左右时,Mn2+的萃取率能达到80%以上而Co2+的萃取率不足20%,可以除去Co2+中的Mn2+。根据给出的试剂,调节溶液的PH至
氧化后的溶液中含有Fe3+、Al3+、Mn2+、Co2+、Na+、Cl-、SO42-等离子,可以通过调节溶液的PH除去Fe3+和Al3+,根据金属离子沉淀的PH范围的表格可知需要控制溶液的PH在5.2到7.6之间,使Fe3+、Al3+完全沉淀而Co2+不沉淀。Mn2+不能通过调节溶液的PH的方法除去,根据金属萃取剂对金属离子的萃取率与pH的关系图像可知,Mn2+可以用萃取的方法除去,在PH在3.5左右时,Mn2+的萃取率能达到80%以上而Co2+的萃取率不足20%,可以除去Co2+中的Mn2+。根据给出的试剂,调节溶液的PH至![]() 的试剂用Na2CO3溶液,调节溶液pH至
的试剂用Na2CO3溶液,调节溶液pH至![]() 左右,用的试剂是稀盐酸,
左右,用的试剂是稀盐酸,
故答案为:![]() 溶液,调节溶液的pH至
溶液,调节溶液的pH至![]() ,过滤,向滤液中加入稀盐酸调pH至
,过滤,向滤液中加入稀盐酸调pH至![]() 左右,加入金属萃取剂萃取
左右,加入金属萃取剂萃取![]() 次,静置后分液,得较纯
次,静置后分液,得较纯![]() 溶液。
溶液。

 口算能手系列答案
口算能手系列答案【题目】下列操作与现象、结论都正确且有相关性的是
选项 | 操作 | 现象 | 结论 |
A |
|
| 原溶液中仍有 |
B | 向含有ZnS和 | 生成黑色沉淀 |
|
C | 向 | 溶液变浑浊 | 酸性 |
D | 向乙酸乙酯粗产品中加入少量 | 产生大量气泡 | 乙酸乙酯产品中混有乙醇 |
A.AB.BC.CD.D